صفر تا صد ساختار و عملکرد عضله اسلکتی

از ابتدای صبح که روزمان را شروع میکنیم تا انتهای شب که به خواب میرویم، در حرکت هستیم. از غذاخوردن و جویدن غذا تا راه رفتن و دویدن همه به وسیله عضلات اسکلتی انجام میشود. بدنسازان به دنبال تقویت ماهیچه های اسکلتی هستند تا فرم بدنی جذابتر و زیباتری داشته باشند.
لازم است برای درک هر آنچه حین و پس از فعالیت ورزشی در بدن ما می گذرد، با یکی از اصلیترین اعضای بدن که باید یعنی عضله آشنا شویم. در این مقاله با ساختار عضله اسکلتی و سلول های عضلانی آشنا خواهیم شد. قبل از هرچیز باید بصورت اجمالی بررسی کنیم که عضله چیست؟
عضله چیست؟
عضلات، بافت های تخصص عملکردی هستند که مسئولیتهای متنوعی از جمله انقباض، حرکت و انبساط هستند. از بزرگترین عضلات بدن ما مثل عضله چهار سر ران تا کوچک ترین عضلات مثل عضلات پلک، از سلولهای عضلانی تشکیل شدهاند.
انواع عضله در بدن انسان
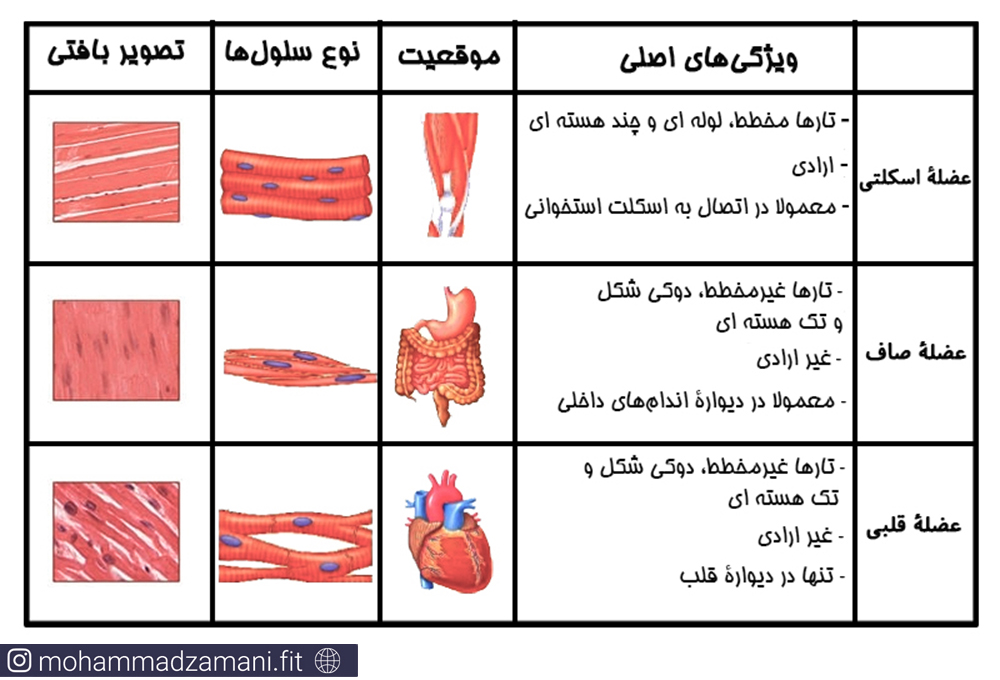
به طور کلی، سه نوع عضله در بدن ما وجود دارد: عضلات صاف، عضله اسکلتی و عضله قلبی. ویژگی مشترک تمامی این عضلات، عملکرد انقباضی آن هاست. البته این عضلات تفاوتهایی با هم دارند که متناسب با وظایف آنها است. مثلا ساختار عضله اسکلتی با ساختار عضله قلبی متفاوت است. از آنجایی که بحث اصلی این مقاله در خصوص ماهیچهی اسکلتی است، لذا به صورت کلی به معرفی عضله قلبی و عضله صاف میپردازم و پس از آن، بصورت مفصل سلول عضلانی اسکلتی را بررسی میکنم.
عضله قلبی: همانطور که از اسمش پیداست، مسئولیت انقباضات مادام العمر قلب، به عهده عضله قلبی است و فقط در یک جای بدن یعنی قلب وجود دارد.
عضله صاف: عضله صاف، عضلات غیر ارادی هستند که در دستگاه گوارش و عضلات ناحیه تناسلی وجود دارند.
در شکل زیر، تفاوت و ویژگیهای هر سه نوع عضله به طور خلاصه ارائه شده است
در ادامه به بررسی عضله اسکلتی، عضلهی حرکات روزانه میپردازیم:
عضله اسکلتی چیست؟
برای درک اینکه ماهیچه اسکلتی چیست، باید به نام آن توجه کنیم.
همانطور که از نام عضلات اسکلتی بدن انسان مشخص است، ماهیچه اسکلتی مسئول حرکت دادن استخوانها و اسکلت بدن ما هستند و باعث میشود ما بتوانیم حرکت کنیم. از این رو، ماهیچههای اسکلتی معمولاً به اسکلت استخوانی اتصال دارند و با کوتاه شدن خود، باعث کشیده شدن استخوان و در نتیجه ایجاد حرکت میشوند. تعداد عضلات اسکلتی بدن انسان بیش از 600 عدد است که هریک عملکرد مخصوص به خود را دارند. با این حال، تمام عضلات اسکلتی بدن، در نحوه اجرای عملکرد خود مشترکند. به این معنی که فرایند انقباض در همهی عضلات اسکلتی بدن به یک شکل اتفاق می افتد.
ویژگی ماهیچه اسکلتی، این است که برخلاف انواع دیگر عضلات، مغز قابلیت کنترل آن ها به صورت ارادی را دارد. به این معنی که فرد میتواند به شکل ارادی، انقباض و استراحت عضله و حتی شدت انقباض آن ها را کنترل کند. این مورد بسیار قابل درک است. برای مثال، همهی ما می توانیم حتی بدون حرکت دادن مفصل آرنج یا بازو، عضله جلوبازوی خود را منقبض کنیم. در حالی که برای دو نوع دیگر عضلات موجود در بدن چنین امکانی وجود ندارد.
ساختار سلولی و فرایند انقباض در عضلات اسکلتی در بخش های بعدی به طور مفصل ارائه شده است. در این بخش به خلاصه ای از ساختار سلولی آن اکتفا می کنیم.
بخش دوم: ساختار عضله اسکلتی
پس از مقدمه کلی درباره انواع عضله، باید ساختمان عضلات اسکلتی، به عنوان یکی از اصلی ترین بافت درگیر در عملکرد ورزشی، را بهتر بشناسیم.
انقباض در یک عضله، حاصل فعالیت انقباضی تک تک سلول های تشکیل دهنده آن است. برای درک این فرایند، ابتدا باید با ساختار عضلات اسکلتی و سلول های سازنده آن آشنا شویم.
ساختار پوششی عضلات اسکلتی
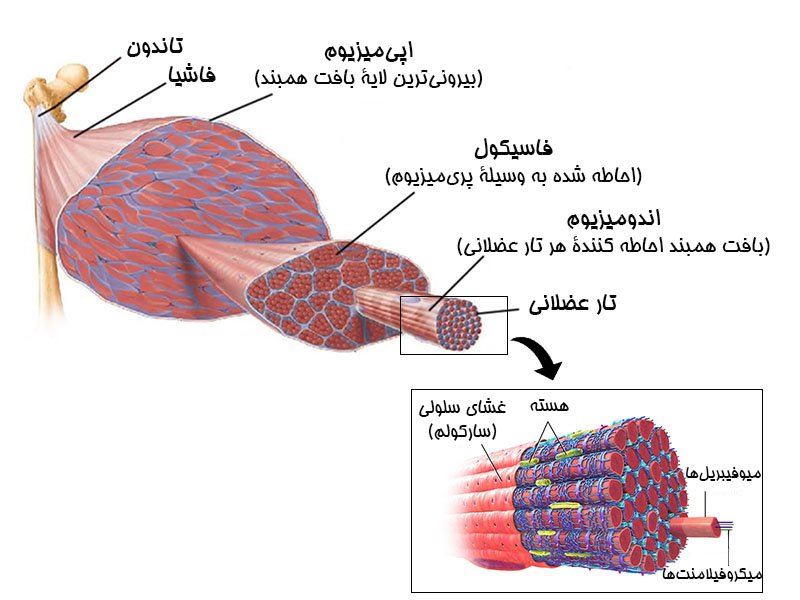
در ابتدا بهتر است ساختمان تار عضلانی را مورد بررسی قرار دهیم.
هر تار عضلانی، توسط لایه نازکی از بافت همبند، بنام اندومیزیوم (Endomysium) احاطه شده است. تار های عضلانی به شکل دسته ای درون عضلات قرار گرفته اند و هر دسته تار، فاسیکول نامیده می شود که توسط لایه ای از بافت همبند، بنام پریمیزیوم (Perimysium) احاطه شدهاند. مجموع فاسیکول ها در کنار هم، یک عضله را می سازند. خود عضله نیز توسط لایه ای دیگر از بافت همبند بنام اپیمیزیوم (Epimysium) دربرگرفته شده است. بر روی اپیمیزیوم، لایه دیگری از بافت همبند ضخیم تر و بسیار مقاوم قرار گرفته است که علاوه بر حفظ تمامیت عضله، تا حد زیادی از آسیب دیدن آن جلوگیری می کند.
بخش قابل انقباض عضله چه نام دارد
برای درک بهتر این بخش، باید بررسی کنیم که سارکومر چیست؟
درون تار عضلانی، بیشترین فضای داخل سلول را ساختارهای تخصص عمل یافتهای از میکروفیلامنت ها اشغال کرده اند که در ارتباط باهم واحدهای انقباضی را می سازد. این واحد های انقباضی، سارکومر نام دارند. اگر بخواهیم ساختار سارکومر را بررسی کنیم، در واقع بخش قابل انقباض عضله است. لوله های عرضی T اگرچه پروتئین های بسیاری در ساختمان سارکومر وجود دارد، ولی بدنه اصلی سازنده آن، سه میکروفیلامنت اکتین، میوزین و تیتین است که نحوه قرار گیری آن ها را در شکل زیر مشاهده می کنید.
بیشتر بخوانید: صفر تا صد تاثیر مکمل وی بر حجم و عضله سازی
در ادامه شکل سارکومر را مشاهده میکنید:
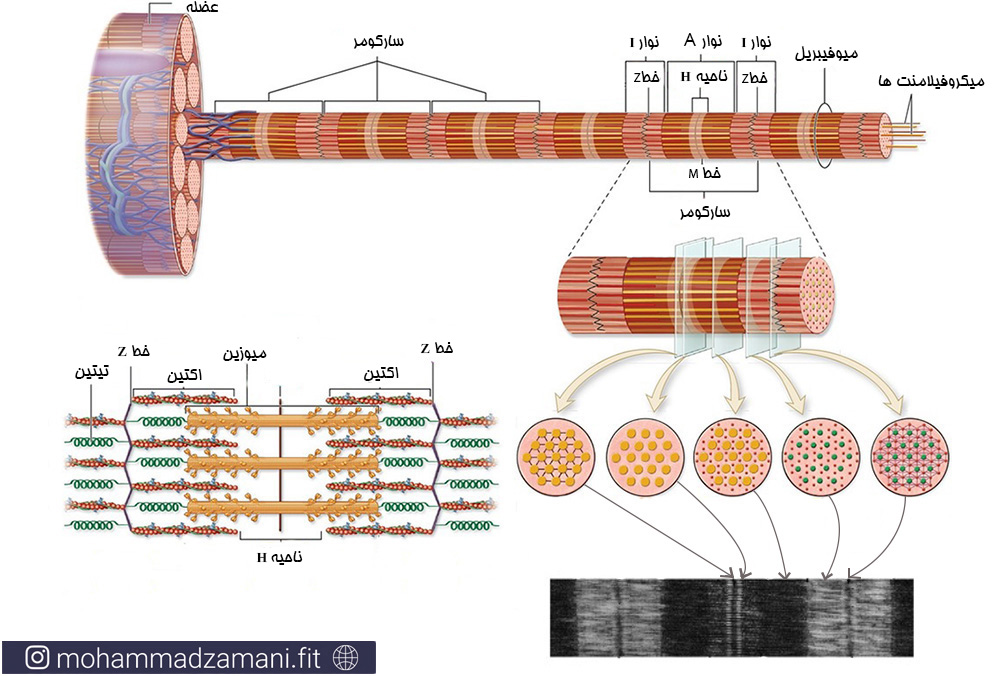
دیسک یا خط Z محل اتصال فیلامنت های اکتین به همدیگر است که در زیر میکروسکوپ به شکل خط پررنگی در مرکز نوار کمرنگ دیده می شود. اگر میوفیبریل را از محل خط Z به صورت عرضی برش دهیم، تنها میکروفیلامنت های اکتین را مشاهده خواهیم کرد. به ناحیه کمرنگی که زیر میکروسکوپ مشاهده می شود و از انتهای میوزین یک سارکومر تا ابتدای میوزین سارکومر مجاور ادامه دارد، نوار I می گویند. خطZ در سارکومر در مرکز نوار I قرار دارد.
حد فاصل هر دو خط Z، یک سارکومر نامیده می شود که کوچک ترین واحد انقباضی شناخته شده است. طول سارکومر متغیر بوده و با انقباض و جمع شدن عضله کوتاه تر می شود و برعکس. در حالت استراحتی، بسته به وضعیت مفاصل، طول سارکومر 5/1 تا 5/2 میکرومتر است.
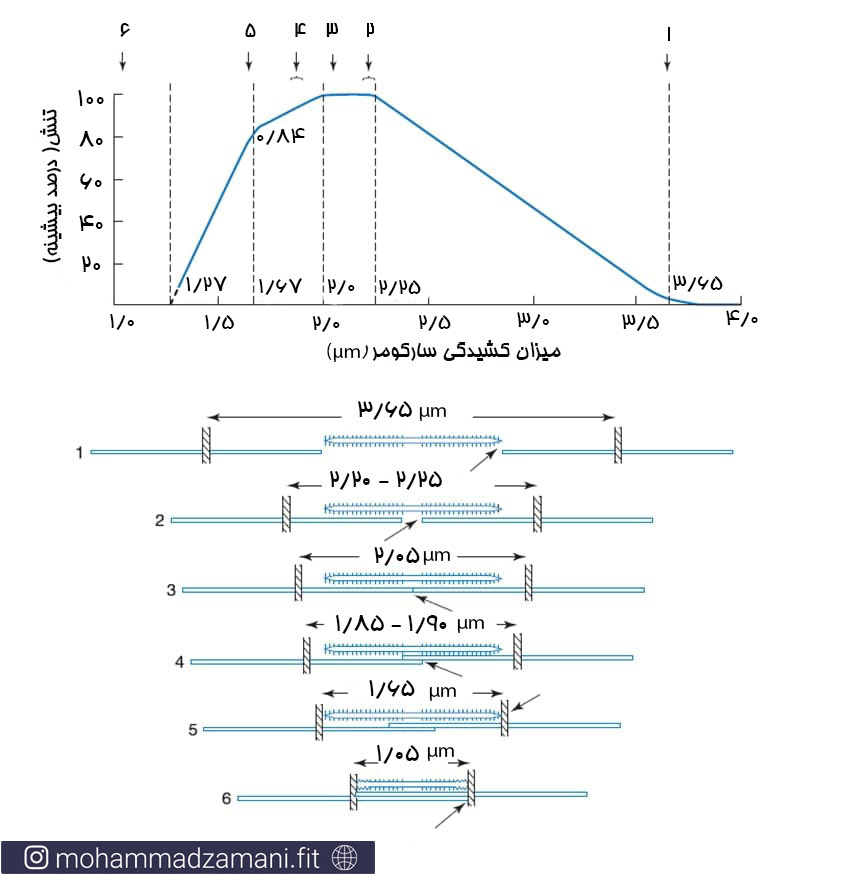
بیشترین بازده نیروی سارکومر، در طول 2 تا 25/2 میکرومتر تولید می شود.
درون سارکومر، حد فاصل دو انتهای میوزین، نوار A نامیده می شود. در مرکز نوار A، ناحیه H قرار دارد. اگر میوفیبریل را از ناحیه H به صورت عرضی برش بزنیم، تنها میکروفیلامنت های میوزین را مشاهده خواهیم کرد.
در مرکز ناحیه H، خط M قرار دارد که محل اتصال میکروفیلامنت های میوزین به همدیگر است. اگر میوفیبریل را از این ناحیه برش بزنیم، علاوه بر میوزین، شبکه به هم تنیده ای از پروتئین های متصل کننده میوزین به هم را مشاهده خواهیم کرد.
دقت داشته باشید، همانطور که در شکل بالا نشان داده شده است، چینش میکروفیلامنت ها در کنار هم سه بعدی است. به طوری که اگر میوفیبریل را به صورت عرضی برش دهیم، میکروفیلامنت های یکسان، اشکال شش ضلعی ای را می سازند که در هر رأس آن یک میکروفیلامنت قرار گرفته است.
ساختار میکروفیلامنتهای انقباضی اکتین
آنچه در زیر میکروسکوپ به شکل فیلامنت نازک دیده می شود، اکتین نامیده شده است. اکتین در واقع رشته ای به هم پیچیده از دو پروتئین رشته ای F-اکتین، دو پروتئین رشته ای تروپومیوزین و چندین پروتئین سه بخشی به نام تروپونین است که با فاصله مشخص و به صورت چسبیده به تروپومیوزین قرار دارد. این سه پروتئین سازنده اکتین، هریک ویژگی های منحصر به فرد خود را دارند.
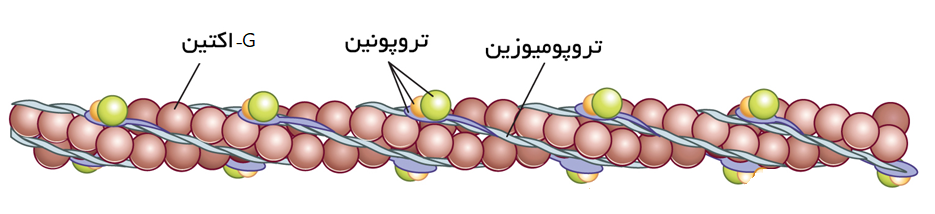
هر پروتئین رشته ای F-اکتین، از مولکول های پیوسته G-اکتین ساخته شده است. مولکول های G-اکتین مانند یک رشته تسبیح مانند در کنار هم قرار گرفته اند و بر روی هر مهره آن یک قسمت فعال وجود دارد که توانایی چسبیدن به سر میوزین را دارد. اما در حالت استراحت، نوارهای تروپومیوزین به نحوی با این رشته های F-اکتین در هم تنیده شده است که این قسمت ها فعال را می پوشاند.
به فاصله های مشخص بر روی اکتین، کمپلکس پروتئینی تروپونین قرار دارد که دارای سه بخش به نام های تروپونین I، تروپونین C و تروپونین T است (2).
ساختار میکروفیلامنت های انقباضی میوزین
بر خلاف اکتین، میوزین تنها از مولکول های میوزین ساخته شده است. هر مولکول میوزین، یک پروتئین سه بخشی است که از دو سر، دو گردن و دو دم به هم پیچیده ساخته شده است. چندین مولکول میوزین به شکل بهم تنیده در کنار هم قرار گرفته و فیلامنت های میوزین را می سازد. هر سر میوزین دارای سه بخش است: محل اتصال به اکتین، محل اتصال به ATP و ناحیه ATPase که یک آنزیم تجزیه کننده ATP است (3).
پتانسیل عمل عضله اسکلتی سیستم توبولی در عضلات اسکلتی
در ابتدا باید بررسی کنیم که توبول عرضی چیست؟ غشای سلول های عضلانی (سارکولم) به فاصله های منطم به درون سلول فرورفته و ساختاری به نام توبول های عرضی یا توبول T را بوجود آورده اند. شبکه اندوپلاسمی یکی از تخصص یافته ترین ساختار ها درون سلول عضلانی است که در سلول عضلانی به آن شبکه سارکوپلاسمی می گویند. شبکه سارکوپلاسمی در ارتباط با توبول های عرضی، یک شبکه لوله ای منظم به وجود آورده است که در موازات میوفیبریل ها قرار گرفته است. در مجاورت توبول های T، در دو سمت، شبکه سارکوپلاسمی عریض شده و ساختار تخصص یافته ای به نام سه گانه (Triad) را می سازند. در این ساختار، انتهای شبکه سارکوپلاسمی به عنوان مخازن کلسیم عمل می کند و در مجاورت توبول های T، نقش اساسی در انتقال پیام انقباض از غشا به اعماق میوفیبریل بازی می کند. در بخش بعد این عملکرد به طور دقیق بررسی خواهد شد.
بخش سوم: انقباض در عضله اسکلتی
اکنون که دید کلی از ساختار عضله اسکلتی یافتیم، بیایید ببینیم چه می شود که عضله اسکلتی منقبض می شود؟
مکانیسم کلی انقباض عضلانی
کل فرایند انقباض در عضله اسکلتی، از شروع تا پایان، شامل مراحل زیر است:
1. یک پتانسیل عمل (پیام عصبی که به وسیله سلول های عصبی منتقل می شود) از طریق عصب حرکتی به محل اتصال عصب به تار عضلانی در پایانه عصب، می رسد.
2. در هر پایانه، عصب، مقادیر اندکی از نوروترنسمیتر (ناقل عصبی) استیل کولین ترشح می کند.
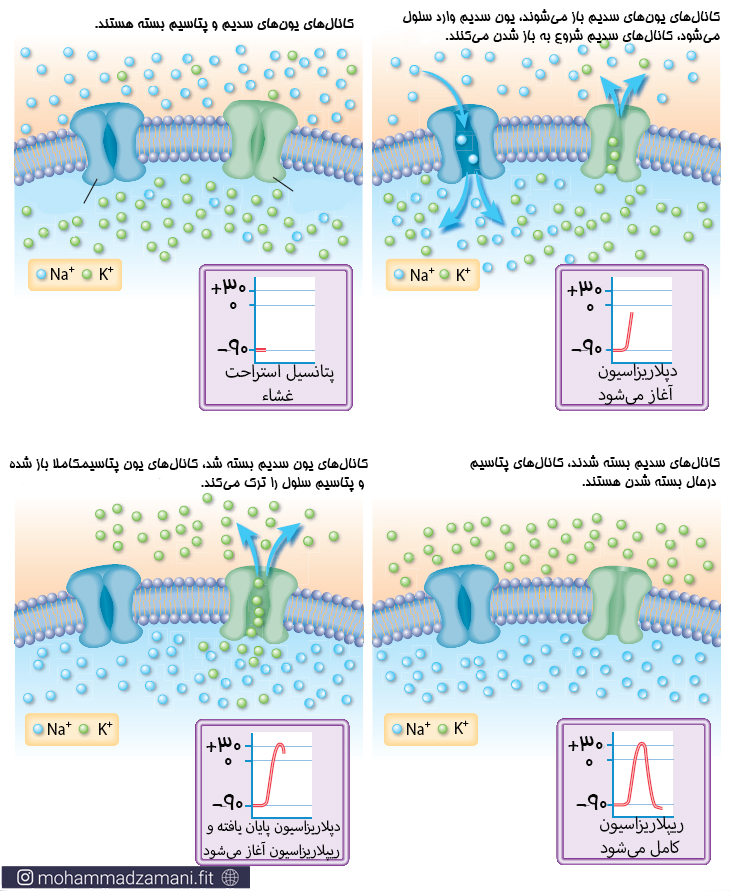
3. در محل اتصال عصب به عضله (سیناپس)، استیل کولین با اتصال به گیرنده ی کانالی خود، به صورت موضعی باعث باز شدن کانال های سدیمی می شود.
4. باز شدن کانال های وابسته به استیل کولین، باعث ورود مقدار قابل توجهی یون سدیم به داخل سلول عضلانی می شود. این کار باعث دپولاریزاسیون موضعی در محل سیناپس شده و در ادامه باعث باز شدن سایر کانال های ولتاژی سدیم شده و باعث ایجاد پتانسیل عمل در غشای سلول عضلانی می شود.
5. پتانسیل عمل در طول سارکولم حرکت می کند و کل سارکولم را دپلاریزه می کند.
6. پتانسیل عمل از طریق توبول های T به مرکز سلول تار عضلانی می رسد و با تحریک شبکه سارکوپلاسمی، باعث رهایش مقادیر زیادی یون کلسیم، از مخازن موجود در شبکه سارکوپلاسمی، به درون سارکوپلاسم (سیتوپلاسم سلول عضلانی) می شود.
7. یون های کلسیم نیروی جاذبه بین فیلامنت های اکتین و میوزین را فعال می کند و سبب سر خوردن این دو فیلامنت بر روی یکدیگر می شود که همان فرایند انقباض است.
8. پس از کسری از ثانیه، یون های کلسیم، توسط پمپ کلسیم، مجدداً به درون شبکه سارکوپلاسمی پمپ شده و در همانجا ذخیره می شود تا پتانسیل عمل دیگری از راه برسد. بازجذب کلسیم به درون شبکه سارکوپلاسمی، باعث توقف فرایند انقباض می شود.
حالت استراحت و انقباض میوفیبریل ها. سر خورد فیلامنت های اکتین (صورتی نازک) به سمت فضای بین فیلامنت های میوزین (قرمز ضخیم) سر می خورند و به این صورت باعث کم شدن فاصله نوارهای Z از هم می شوند.
فرایند انقباض عضلات اسکلتی
بیایید فرایند انقباض عضله اسکلتی را بررسی کنیم.
رسیدن پیام عصبی به NMJ
پیام انقباض از طریق سیگنال عصبی به محل اتصال (سیناپس) پایانه های آکسونی به عضله، بر روی سارکولم می رسد. به محل اتصال پایانه عصبی به سطح سلول عضلانی، اتصال عصبی-عضلانی (Neuromuscular junction) یا به اختصار NMJ می گویند. رسیدن پیام به پایانه عصبی، باعث رهایش نوروترنسمیتر (ناقل عصبی) از پایانه عصب به فضای بین سیناپسی (فضای ایجاد شده بین پایانه عصب و سارکولم) می شود. در اتصال عصبی-عضلانی در عضلات اسکلتی، این ناقل، استیل کولین است. استیل کولین به صورت ذخیره و درون ویزیکول هایی در پایانه عصبی قرار دارد. رسیدن سیگنال به پایانه عصبی، باعث اتصال ویزیکول های حاوی استیل کولین به غشا و ترشح آن ها می شود.
انتقال پیام به عضله
استیل کولین پس از رها شدن از پایانه عصبی، به گیرنده خود بر روی غشای پس سیناپسی (در مورد اتصال عصبی-عضلانی، غشای پایانه عصبی، غشای پیش سیناپسی و سارکولم غشای پس سیناپسی است) می چسبد. گیرنده استیل کولین، در واقع یک کانال سدیمی است که در حالت استراحتی، غیر فعال است و با اتصال به استیل کولین فعال می شود. سپس سدیم شروع به ورود به داخل سارکولم کرده و تا حدی غشا را دپلاریزه می کند.
به پتانسیل غشا پس از ورود سدیم از طریق گیرنده های استیل کولین، EPP (End Plate Potential) می گویند. برای این که یک پتانسیل عمل بتواند در غشای سلول عضلانی ایجاد شده و منتشر شود، EPP باید به قدر کافی قوی باشد. در سلول های عصبی، 20 تا 30 میلی ولت دپلاریزه شدن غشا، می تواند برای ایجاد پتانسیل عمل کافی باشد. در سلول عضله اسکلتی، به نظر می رسد، این آستانه کمی بیشتر است و EPP باید حدود 40 میلی ولت باشد تا بتواند شروع یک پتانسیل عمل را کلید بزند (10). بنابراین، به طور میانگین اگر در اثر EPP پتانسیل غشا به حدود 50- برسد، احتمالاً می تواند باعث تحریک ایجاد یک پتانسیل عمل در سارکولم شود. در شکل زیر، سه EPP متفاوت را نشان میدهد (A، B و C) که از بین آنها تنها مورد B توانسته است به حد آستانه برسد.
پتانسیل صفحه انتهایی (به میلی ولت). A و C: کاهش پتانسیل صفحه انتهایی که ضعیفتر از آن است که بتواند یک پتانسیل عمل ایجاد کند. B: پتانسیل صفحه انتهایی طبیعی که توانسته است باعث ایجاد پتانسیل عمل شود.
ایجاد پتانسیل عمل و انتشار آن
رسیدن EPP به آستانه، باعث تحریک و باز شدن کانال های سدیمی ولتاژی در سیناپس و مجاورت آن شده و یون های سدیم به درون سلول سرازیر می شود. دپلاریزه شدن غشا در هر قسمت باعث تحریک کانال های سدیمی ولتاژی مجاور شده و به این ترتیب پتانسیل عمل در طول سارکولم و از همه جهت منتشر می شود. پانسیل عمل در مسیر انتشار خود، وارد توبول های T شده و به ساختار سه گانه می رسد.
جفت شدن تحریک-انقباض
ورود موج دپلاریزاسیون به توبول های T باعث تحریک گیرنده دی هیدروپیریدینی (DHP) در ساختار سه گانه می شود. گیرنده دی هیدروپیریدینی اتصال مکانیکی با پروتئین رایانودین (RYR) دارد که کانال کلسیم بر روی مخازن کلسیمی شبکه سارکوپلاسمی است. با رسیدن موج دپولاریزاسیون به توبول T، گیرنده DHP تغییر فضایی یافته و باعث باز شدن کانال کلسیم می شود. به این ترتیب کلسیم از مخازن خود خارج شده و در سارکوپلاسم رها می شود. با رسیدن موج ریپلاریزاسیون به DHP، مجدد کانال کلسیم بسته شده و خروج کلسیم متوقف می شود. همزمان، پمپ کلسیمی وابسته به ATP بر روی شبکه سارکوپلاسمی فعال شده و کلسیم را مجدداً به درون شبکه سارکوپلاسمی و مخازن کلسیم می کشد. به این پمپ کلسیمی SERCA (Sarcoplasmic Reticulum Calcium ATP-ase) گفته می شود. در طی ریپلاریزاسیون (شکل پایین)، تغییرات ساختاری مجدد در گیرنده DHP باعث بسته شدن کانال های رهایش کلسیم شده و کلسیم از طریق پمپ کلسیمی وابسته به ATP از سارکوپلاسم به شبکه سارکوپلاسمی منتثل می شود. این پمپ SERCA (Sarcoplasmic Reticulum Ca2+-ATPase) نامیده می شود.
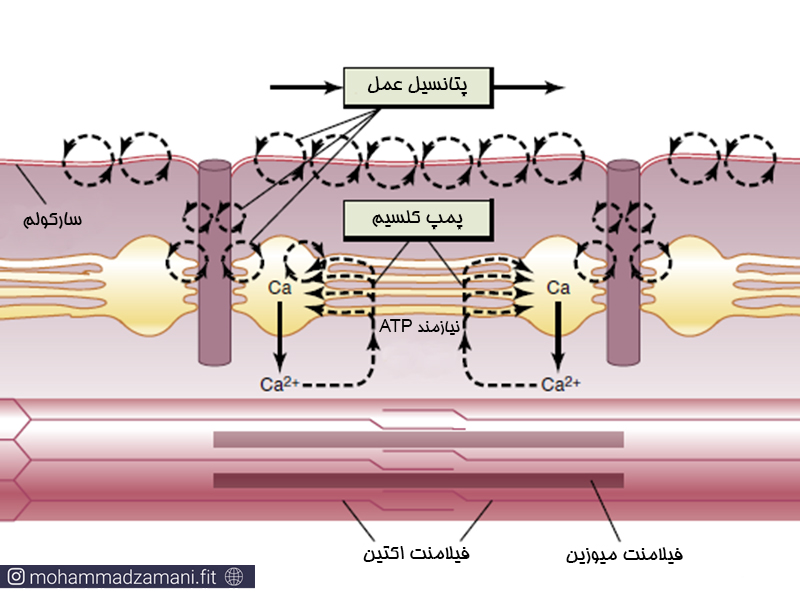
جفت شدن تحریک انقباض در عضله، رهایش کلسیم در اثر رسیدن پتانسیل عمل به توبول های عرضی و باز برداشت آن به درون شبکه سارکوپلاسمی توسط پمپ SERCA
چرخه پل عرضی
در شکل زیر می توانید نحوه قرارگیری فیلامنت های اکتین و میوزین را نسبت به یکدیگر در حین استراحت و انقباض ببینید. فرایند سرخوردن فیلامنت های اکتین و میوزین بر روی هم که منجر به تغییر طول در سارکومر می شود، چرخه پل عرضی نام دارد. رهایش کلسیم به درون سارکوپلاسم و رسیدن آن به فیلامنت های انقباضی اولین گام در شروع چرخه پل عرضی است. با اتصال کلسیم به تروپونین، رشته تروپومیوزین تغییر موقعیت می دهد و نقاط فعال موجود در رشته اکتین، برای اتصال سر های میوزین نمایان می شود. در گام بعد، سر های میوزین به این نقاط فعال می چسبند و سپس با یک ضربه پر توان، میوزین بر روی اکتین سر می خورد و به مرکز سارکومر نزدیک تر می شود. با این کار، مولکول ADP و Pi متصل به سر میوزین رها می شود. سپس یک مولکول ATP به سر میوزین می چسبد. میوزین با تجزیه کردن این ATP به ADP و Pi، از اکتین جدا شد و به حالت اول خود بر می گردد و سپس کلسیم متصل به تروپونین رها می شود. چنانچه روند انقباض ادامه یابد، همین چرخه به همین ترتیب ادامه یافته و رفته رفته طول سارکومر کوچک تر می شود که در ظاهر عضله به صورت کوتاه شدن طول کل عضله خود را نشان می دهد.
بخش چهارم: انواع سلول عضله اسکلتی
در این بخش، می خواهیم با انواع تار عضلانی، عملکرد و نحوه تمایز آن ها آشنا شویم. برای اینکه بتوانیم درک عمیقی از انواع سازگاری های ناشی از تمرین ورزشی در بسیاری از سیستم ها بدن داشته باشیم، اولین گام شناخت انواع تار عضلانی است.
واحد حرکتی
تنها سیستم کنترل کننده انقباض یا عدم انقباض عضله اسکلتی، سیستم عصبی است. در واقع برای این که یک تار عضلانی بتواند منقبض شود، ابتدا باید توسط سیستم عصبی تحریک شود. به این منظور، هر تار عضلانی توسط یک تار عصبی، عصب رسانی می شود. دقت داشته باشید که اگر چه یک تار عصبی می تواند با انشعابات متعددی که در انتهای آکسون می یابد، همزمان چندین تار عضلانی را عصب دهی کند، اما هر تار عضلانی تنها توسط یک تار عصبی می تواند عصب دهی شود. به مجموع یک تار عصبی و تار های عضلانی که توسط آن عصب رسانی می شوند، یک واحد حرکتی (motor unit) گفته می شود.
تعداد تار عضلانی موجود در هر واحد حرکتی، بسته به نوع حرکتی که انجام می شود می تواند بسیار متفاومت باشد. هر قدر حرکاتی که عضله انجام می دهد ظریف و دقیق باشد، واحد حرکتی کوچک تر است. برای مثال در عضلات درگیر در حرکت چشم، در هر واحد حرکتی، حدود 6 تار عضلانی وجود دارد. به همین نسبت، هر قدر که حرکت ایجاد شده در عضله، بدون نیاز به ظرافت و با قدرت بیشتری باشد، واحد حرکتی بزرگتر است. مثلاً در عضلات جلو ران هر عصب حرکتی، ممکن است هزاران تار عضلانی را عصب رسانی کند (12).
اصل همه یا هیچ
تارهای عضلانی موجود در یک واحد حرکتی، الزاماً همجوار نیستند. با اینحال، هر تحریک عصبی ایجاد شده در یک تار عصبی حرکتی، به انقباض همه تارهای عضلانی عصب رسانی شده، توسط آن تار عصبی منجر می شود.
اصل همه یا هیچ به این مورد اشاره می کند که قدرت انقباض تار های عضلانی، به شدت تحریک عصبی بستگی ندارد. به عبارت دیگر، هر سیگنال عصبی که به عضله می رسد، تنها دو پاسخ ایجاد می کند: یا به آستانه تحریک نمی رسد و منجر به پتانسیل عمل در عضله نمی شود؛ یا به آستانه می رسد و همه تار های عضلانی موجود در واحد حرکتی را منقبض می کند، بدون این که تأثیری بر قدرت عضلانی ایجاد شده توسط هر تار عضلانی داشته باشد.
قدرت عضلانی، در واقع ارتباط مستقیم با اندازه واحد حرکتی دارد. هر چقدر تعداد تار های عضلانی موجود در واحد حرکتی بیشتر باشد، تحریک عصب مربوطه، قدرت عضلانی بیشتری ایجاد خواهد کرد. پس:
" ایمپالس عصبی با هر قدرتی، یا منجر به پاسخ نمی شود، یا حداکثر پاسخ را ایجاد می کند."
زمانی که تحریک به آستانه برسد، پاسخ کامل ایجاد خواهد شد. دقت کنید که تحریک بزرگتر منجر به پاسخ بزرگتر نخواهد شد و برعکس.
همچنین بخاطر داشته باشید که هر تار عضلانی در عضله اسکلتی، از یک سر عضله شروع شده و تا سر دیگر عضله ادامه می یابد. بنابراین، یک ایمپالس عصبی اگر منجر به ایجاد پتانسیل عمل در هر قسمتی از سارکولم شود، انقباض عضلانی در تمام طول تار عضلانی اتفاق خواهد افتاد. بنابراین، هیچ حرکتی نمی تواند تنها به انقباض بخشی از تار عضلانی منجر شود.
انواع واحدهای حرکتی
همانطور که پیشتر نیز اشاره شد، هر واحد حرکتی از یک تار عصبی و چند تار عضلانی تشکیل شده است. علی رغم اینکه نوع واحد حرکتی تا حد زیادی به ویژگی های تار عضلانی بستگی دارد، اما تفاوت تار های عصبی در واحدهای حرکتی مختلف نیز قابل توجه است. در واقع در یک واحد حرکتی، نوع تار عصبی و تار عضلانی با یکدیگر مطابقت دارند و این گونه نیست که یک نوع تار عضلانی، با نوع متفاوتی از تار عصبی، عصب دهی شده باشد. با این حال، ویژگی متفاوتی در تار عصبی و عضلانی باعث قرار گرفتن هریک در گروه مشخصی می شود. ابتدا به بررسی ویژگی های تار عصبی می پردازیم.
انواع تار عصبی
در منابع علمی مختلف، شاید دسته بندی های متعددی برای انواع تار عصبی در واحد حرکتی مشاهده کنید. با این حال، رایج ترین آن ها، دسته بندی بر اساس سرعت انقباض ایزومتریک و خستگی پذیری تار عصبی است. بر این اساس، تار های عصبی حرکتی (motoneurons) به سه دسته آهسته (Slow)، سریع مقاوم به خستگی (Fast Fatigue Resistence)، سریع خستگی پذیر (Fast Fatigable) تقسیم می شود.
انواع تار عضلانی
اولین مقالات علمی که درباره نوع تار عضلانی منتشر شد، به دهه 1960 و اوایل 1970 برمی گردد. اولین دسته بندی ها، با استفاده از تکنیک های هیستوشیمی انجام شد که تار های عضلانی را بر اساس فعالیت ATPase میوزین در میوفیبریل ها در گروه های متفاوتی قرار می داد (13). بر این اساس، تار های عضلانی به سه دسته آهسته نوع I، سریع نوع IIA و سریع نوع IIB تقسیم شدند. متعاقباً این نامگذاری برای دسته بندی ایزوفرم زنجیره سنگین میوزین (MHC: Myosin Heavy Chain) نیز استفاده شد که ارتباط نزدیکی با ویژگی های عملکردی تار عضلانی داشت. در اوایل دهه 1990، نوع دیگری از ایزوفرم MHC کشف و IIX نامگذاری شد که به تبع آن تار های دارای این نوع ایزوفرم MHC را تارهای سریع نوع IIX نامیدند (14). در اویل دهه 1970، نوع دیگری از نامگذاری نیز انجام شد که اطلاعات بیشتری از ویژگی های مکانیکی و بیوشیمیایی نوع تار عضلانی ارائه می کرد (15). این رویکرد، به نامگذاری تار های عضلانی با نام های اکسیداتیو کند (SO)، اکسیداتیو گلیکولیتیک سریع (FOG) و گلیکولیتیک سریع (FG) انجامید که بسیار رایج است.
تفاوت انواع تارهای عضلانی
تفاوت انواع مختلف تار های عضلانی را می توان در سه بخش از سلول عضله اسکلتی جستجو کرد: 1) پروتئین های انقباضی؛ 2) چرخه کلسیم و شبکه سارکوپلاسمی؛ 3) میتوکندری.
تارهای عضلانی قرمز و سفید
اگر عضله اسکلتی را به صورتی عرضی برش دهیم و در زیر میکروسکوپ نگاه کنیم، طیف رنگی از صورتی بسیار روشن تا قرمز را می توانیم ببینیم. علت این تفاوت رنگ، خونرسانی متفاوت تار های عضلانی مختلف است. همانطور که در جدول اشاره شد، بیشترین میزان چگالی مویرگی و در نتیجه خونرسانی را می توان در تار های عضلانی نوع I آهسته مشاهده کرد. بنابراین، تار های تیره تر، نشان دهنده تار های نوع I آهسته بوده و تار های روشن تر نشان دهنده تار های سریع نوع II است.
تارهای عضلانی هیبریدی
همانطور که پیشتر نیز اشاره شد، اصلی ترین عامل تفاوت در نوع تار های عضلانی، ایزوفرم MHC در میوفیبریل میوزین است. کشف ایزوفرم های مختلف MHC عمری حدود 20 سال دارد. با کشف انواع مختلف ایزوفروم های MHC مشخص شد که نسبت وسیعی از تار های عضلانی چند ریختی (دارای ویژگی های ساختاری بینابینی) در عضلات انسان و گونه های غیر انسان وجود دارد که تار های عضلانی هیبریدی نامیده شده اند. بر این اساس در انسان 7 ترکیب متفاوت از ایزوفرم های MHC کشف شده است. زمانی که این ایزوفرم ها را در ترکیب با ایزوفرم های مختلف MLC (Myosin Light Chain) و نیز در ترکیب با انواع ایزوفرم های پروتئین های درگیر در چرخه کلسیم، چرخه پل عرضی و تنفس سلولی در نظر بگیریم، خواهیم دید که طیف زیادی از انواع سلول از نظر ساختاری یا عملکردی دربدن انسان وجود دارد.
تغییر نوع تار عضلانی
سالیان سال پژوهش و مطالعه، نشان داده است که انواع تار های عضلانی، توانایی تبدیل به همدیگر را دارند. در این مورد، تبدیل تار را با تغییر در ایزوفرم MHC تعیین می کنند که می تواند بر اثر عوامل متفاوت، از جمله قطع عصب محرک عضله، تغییر در محرک های تیروئیدی، عصب دهی متقاطع (عصب دهی با تار عصبی غیر هماهنگ)، ...، تغییر یابد. گروهی از مطالعات نشان می دهد که تبدیل تار های مختلف عضلانی به هم، از الگوی مشخصی پیروی می کند. مثلاً پت و استارون (Pette and Staron ; 2001) نشان دادند که MHC تمایل به تبدیل بر اساس الگوی زیر دارد: IIB ↔ IIX ↔ IIA ↔ I. بر این اساس، یک تار عضلانی در فرایند تبدیل از نوع I به نوع IIB، باید ابتدا به ترتیب به نوع IIA و نوع IIX تبدیل شود. در مقابل گروه دیگری از مطالعات نشان داده اند که تبدیل تار ممکن است از چنین الگویی پیروی نکند (6).
بر اساس توضیحات فوق، می توان گفت علی رغم اینکه تار های عضلانی را می توان بر اساس ویژگی های ساختاری و عملکردی مختلفی که دارند، در یکی از گروه های I، IIA، IIX و IIB دسته بندی کرد، اما اولاً این نسبت در عضلات ثابت نبوده و تار های عضلانی می توانند به هم تبدیل شوند؛ ثانیاً تار های عضلانی هیبریدی با ویژگی های بینابینی در ترکیب تار های عضلانی وجود خواهد داشت که بسته به شرایط مختلف می تواند در هریک از گروه های بالا جای بگیرد.