چرخه انرژی و تبدیل غذا به انرژی درون سلول

مقدمه
هر رویدادی که در جهان اتفاق می افتد، نیازمند انرژی است. یکی از بارزترین رویداد های نیازمند انرژی، حرکت است که در این مورد، هم به معنای جابجایی و هم به معنای رشد و تکامل می باشد. از این منظر، هر اتفاقی که درون بدن یک موجود زنده -از جمله انسان- می افتد، نیازمند انرژی است. در این مقاله قصد داریم روند تولید انرژی درون بدن را بررسی کنیم. فرایند تولید انرژی در سلول ها بسیار پیچیده است و درک همه جزئیات آن، نیاز به سال ها مطالعه دارد. آنچه در این مقاله ذکر می شود تنها کلیاتی از آن است که دانستن آن برای هر مربی، ضروری است.
فصل اول: سوخت سلول ها
چه می آموزیم؟
در این بخش، نگاه کلی خواهیم داشت به موادی که سلول از آنها انرژی تأمین می کند.
انرژی کجا تولید می شود؟
بدن انسان و هر موجود زنده ای، از واحد های ساختاری بسیار کوچک میکروسکوپی، به نام سلول تشکیل شده است. این سلول ها، همگی دارای ساختار مشابه، اما عملکرد نسبتاً ویژه هستند که در ارتباط با یکدیگر، منجر به حفظ و ادامه حیات موجود زنده می شوند. از این نظر، سلول، محل کلید خوردن تمام اتفاقات ضروری برای حفظ و تدام حیات است که تولید انرژی مهم ترین آن هاست.
تولید انرژی درون سلول، یک فرایند بسیار پیچیده و دقیق است که هر لحظه، درون تک تک سلول های ما در جریان است. مطمئناً شناخت این فرایند، با این همه ظرافت و دقت، شما را شگفت زده خواهد کرد.
سوخت مورد نیاز برای تولید انرژی در بدن چیست؟
برای تولید انرژی، به هر شکلی، نیاز به سوخت اولیه است. مثلاً برای تولید انرژی گرمایی به شکل آتش، باید چیزی بسوزد؛ مانند چوب، نفت، گاز، ... . بدن موجودات زنده و سلول ها نیز، از قاعده مستثنی نیستند و برای تولید انرژی، نیاز به سوخت دارند. سوخت مورد نیاز سلول های بدن ما نیز همان چیزی است که روزانه به عنوان غذا می خوریم. البته نه به این معنی که سلول های ما قورمه سبزی را می سوزانند!
سلول ها چه چیزی را به عنوان سوخت می سوزانند؟
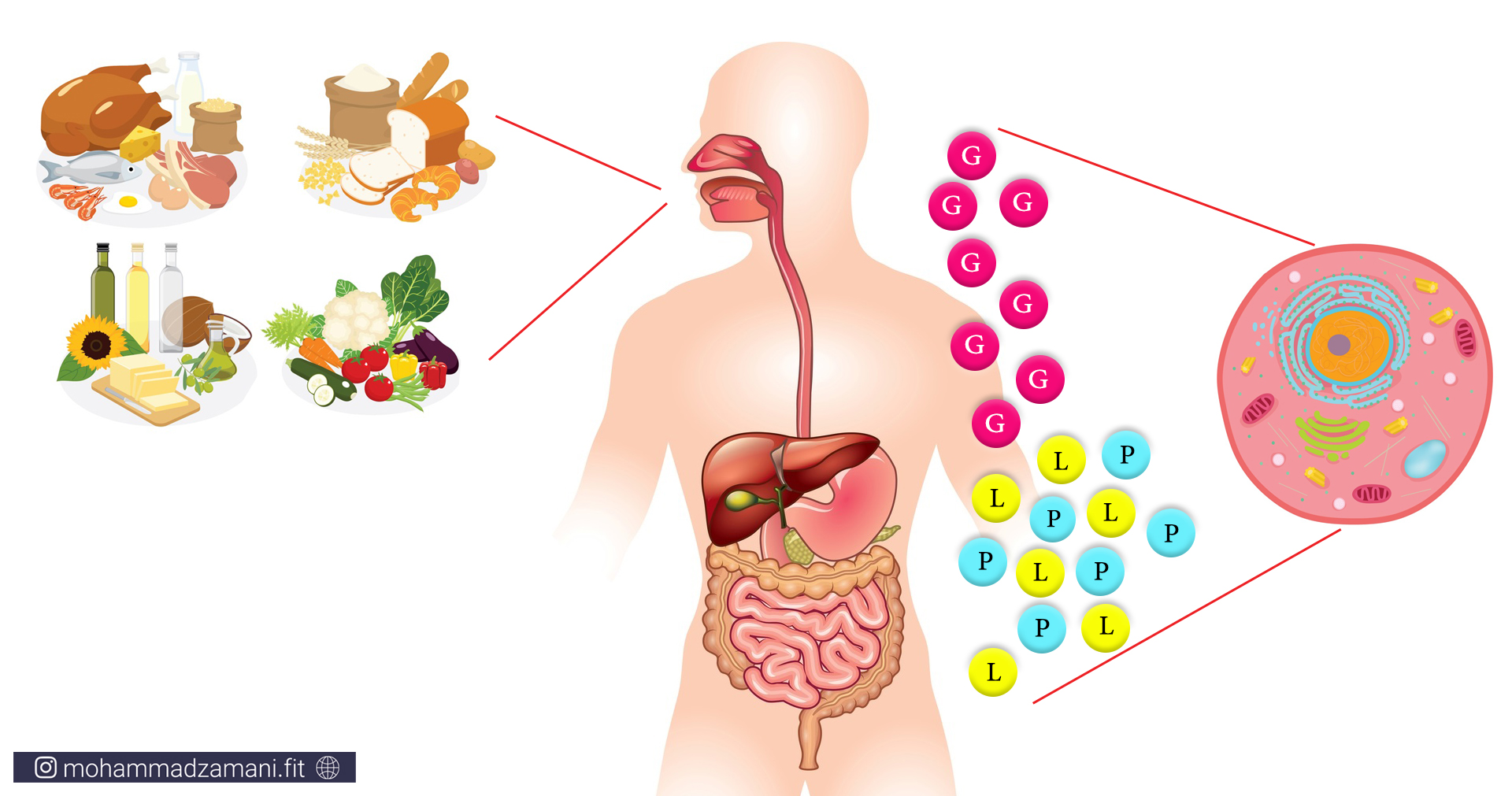
غذای معمول مصرفی روزانه ما، از ترکیبی از سه درشت مغذی پروتئین، کربوهیدرات و چربی تشکیل می شود. هرچیزی به غیر از آب، که ما روزانه می خوریم یا می نوشیم، یکی از این مواد یا ترکیبی از آن ها را درون خود دارد. خود این درشت مغذیها از واحد های مولکولی کوچک تر ساخته شده اند: پروتئین ها از مولکول های اسیدآمینه، چربی ها از اسید های چرب و کربوهیدرات ها از گلوکز یا همان قند. هر چیزی که ما می خوریم، وارد دستگاه گوارش ما شده و طی فرآیند هضم، به این سه مولکول، یعنی اسید آمینه، اسید چرب و گلوکز تبدیل می شود. سپس این مولکول ها وارد جریان خون شده و به بافت های مختلف می رود و توسط سلول های بدن مورد استفاده قرار می گیرد. پس:
«سلول ها، از اسیدچرب، گلوکز و اسیدآمینه به عنوان سوخت استفاده می کنند.»
اولویت با کدام است: اسیدآمینه، اسیدچرب یا گلوکز؟
برای پاسخ به این سوال، بیایید هریک از این مواد را به تفکیک بررسی کنیم.
چربی
از بین سه ماده، فراوان ترین آن ها در بدن چربی است. چربی تنها ماده ایست که قابلیت ذخیره نامحدود در بدن دارد و به همین دلیل میزان آن می تواند متغیر باشد. در واقع، هر کالری اضافی که وارد بدن ما می شود، به هر شکل که مصرف شده باشد -قند، چربی یا پروتئین- در نهایت در بدن تبدیل به چربی شده و ذخیره می شود. مهم ترین مزیت اسیدچرب به عنوان سوخت، اینست که در حضور اکسیژن، می تواند بدون ایجاد تنش اضافی برای بدن، بسوزد و تولید انرژی کند (2).
پروتئین
برعکس چربی، مقدار پروتئین موجود در بدن افراد، دامنه محدودی دارد و در یک فرد با وزن طبیعی، 15 تا 20 درصد از وزن بدن را به خود اختصاص می دهد. به عنوان مثال، اگر فردی 70 کیلوگرم باشد، تقریباً 12 کیلوگرم در بدن خود پروتئین دارد که 40 تا 45 درصد آن در عضلات اسکلتی و در تار های انقباضی است. کمتر از 2% پروتئین بدن، یعنی تقریباً 200 گرم، به شکل اسید های آمینه در پلاسمای خون و مایع بین سلولی و درون سلولی قرار دارد که به مجموع آن استخر آمینواسید می گویند. میزان این اسیدهای آمینه، بسته به شرایط تغذیه ای و فعالیت ورزشی، می تواند اندکی کاهش یا افزایش یابد.
اسیدهای آمینه مختلف، بسته به نسبتی که در عضله دارند، به داخل خون رها می شوند تا اطمینان حاصل شود که آسیب جدی به ساختار عضله وارد نمی شود. با این حال، 6 اسید آمینه لوسین، ایزولوسین، والین (این سه به BCAA معروف هستند)، گوتامات، آسپارتات و آسپارژین، کمتر از سهم نسبی خود در ساختار عضلات، به داخل خون رها می شوند که به این علت است که این اسیدهای آمینه، علاوه بر نقش ساختاری خود در عضلات اسکلتی، در فرآیند های اکسیداسیون، ترنس آمیناسیون و متابولیسم انرژی نیز مشارکت می کنند (1).
به طور کلی، اسیدآمینه، سوخت مطلوبی برای سلول نیست؛ هم به دلیل اهمیت اسیدهای آمینه در ساختار سلول ها و ضرورت آن ها برای بسیاری از عملکرد های حیاتی سلول و هم به این دلیل که در ساختار اسیدهای آمینه، مولکول آمونیاک وجود دارد که هنگام تجزیه آن، آزاد می شود. آمونیاک یک ماده سمی و خطرناک است؛ از اینرو کبد آن را جذب کرده و به اوره تبدیل می کند. این عمل سمیت آن را کاهش می دهد تا برای بدن قابل تحمل شود. بنابراین سوختن پروتئین در سلول، با افزایش اوره در بدن همراه است. در سطوح پایین، این ماده از طریق ادرار دفع می شود. اما چنانچه میزان آن زیاد شود، می تواند در مفاصل رسوب کرده و ایجاد التهاب کند (3).
گلوکز
از بین سه سوخت اصلی سلولی، در دسترس ترین آن ها برای سلول، گلوکز یا همان قند است. گلوکز، نسبت به چربی، مسیر کوتاه تری را تا تبدیل شدن به انرژی طی می کند. همچنین برخلاف دو ماده دیگر، می تواند حتی در غیاب اکسیژن نیز بسوزد.
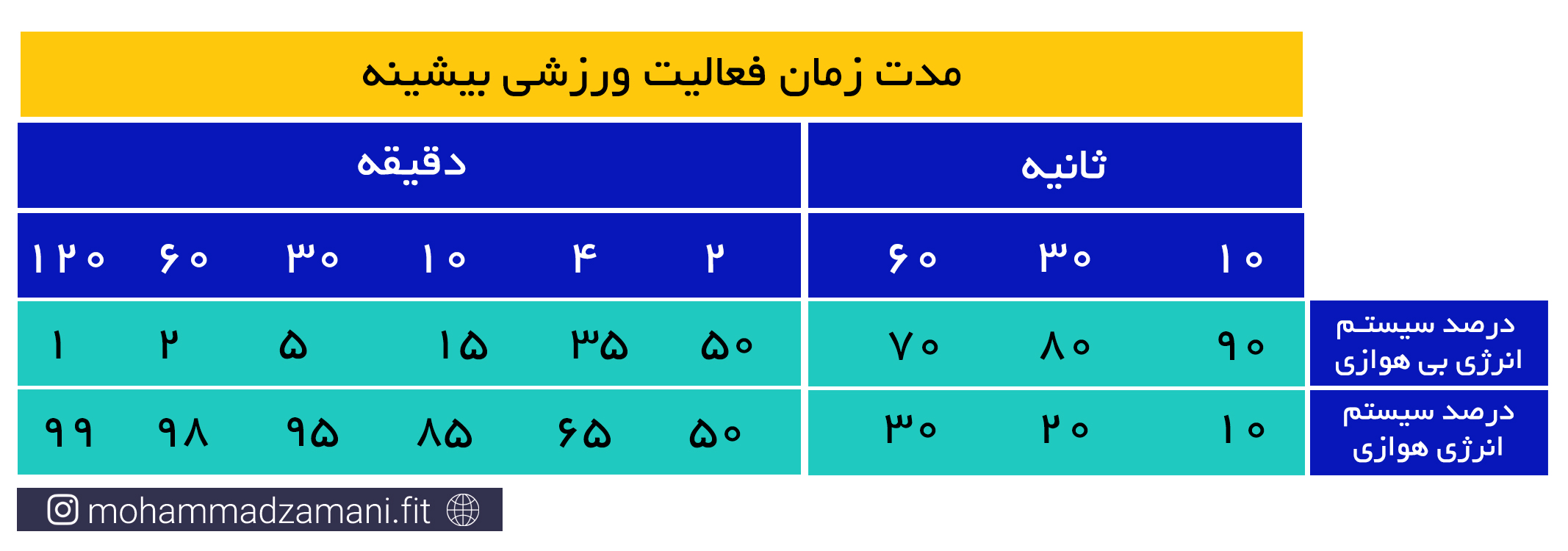
همیشه ذخایری آماده ای از گلوکز به شکل ساده و بیشتر در حالت ترکیبی خود به صورت گلیکوژن، در بدن وجود دارد که می تواند هر لحظه مورد استفاده قرار گیرد. اما در کنار همه این مزایا، چند عیب اصلی نیز دارد. اول این که، توان سوختن گلوکز در غیاب اکسیژن، بسیار محدود است و حداکثر می تواند به مدت 30 ثانیه انرژی مورد نیاز سلول را تأمین کند. دوم این که سوختن گلوکز در غیاب اکسیژن، باعث تولید مواد سمی، درون سلول می شود که می تواند ادامه فرآیند سوخت را با مشکل مواجه کند (4). مورد سوم، ذخایر اندک گلوکز و ترکیب پیچیده آن، یعنی گلیکوژن در بدن است. حدود 4 گرم گلوکز به شکل ساده در بدن وجود دارد که در جریان خون در حال گردش است. همچنین، 100 تا 120 گرم گلیکوژن در کبد و حدود 400 گرم در عضلات اسکلتی یک فرد 70 کیلوگرمی وجود دارد که مجموع همه آن ها، می تواند حدود 2000 کالری انرژی تولید کند که نسبت به چربی، انرژی قابل توجهی محسوب نمی شود (6).
اگرچه اصول ذکر شده درباره سوختن چربی، پروتئین و قند در بیشتر سلول ها جاری است، اما سلول های مختلف، بسته به ساختار و عملکرد ویژه خود، می توانند اولویت های متفاوتی داشته باشند. به عنوان مثال، گلبول های قرمز، فاقد میتوکندری هستند و به همین دلیل، برای تأمین انرژی مورد نیاز خود، فقط قادر به استفاده از گلوکز به صورت بی هوازی (بدون استفاده از اکسیژن) هستند.
فصل دوم: سلول از چه روش هایی برای تولید انرژی استفاده می کند؟
چه می آموزیم؟
تا اینجا، دانسته ایم که بدن برای تولید انرژی از چه موادی استفاده می کند. حال بیایید ببینیم که منظور از انرژی در سلول چیست؟
ATP، پول رایج سلول!
شاید در ذهن شما نیز این سؤال بوجود بیاید که منظور از انرژی در سلول چیست و سلول دقیقاً سوخت خود را به چه چیزی تبدیل می کند؟ پاسخ این سؤال ATP است.
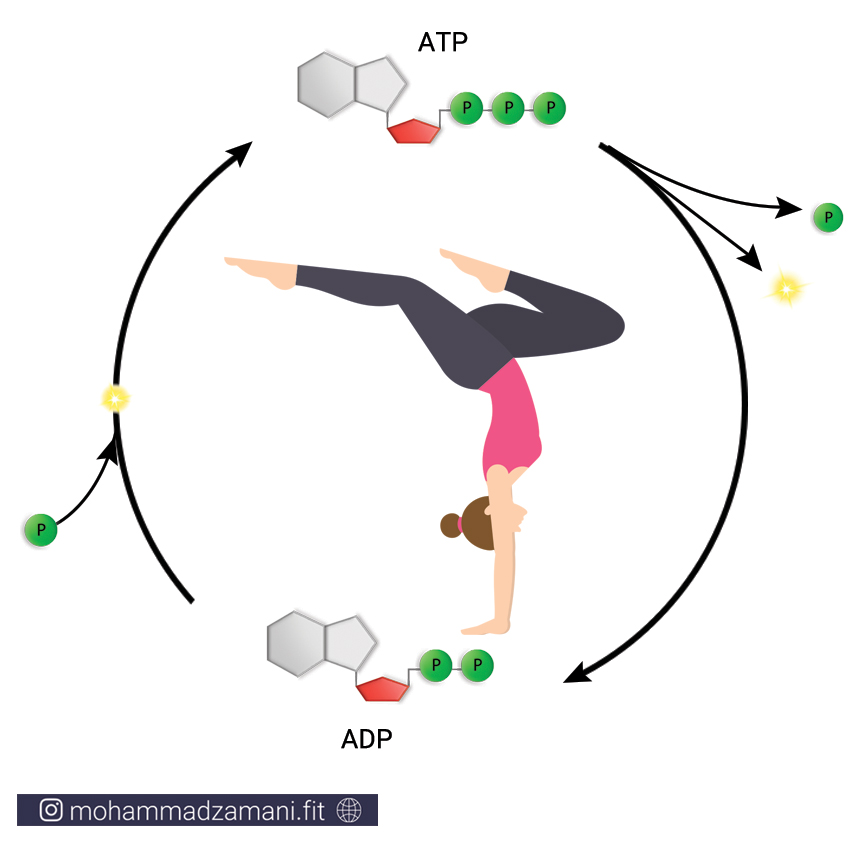
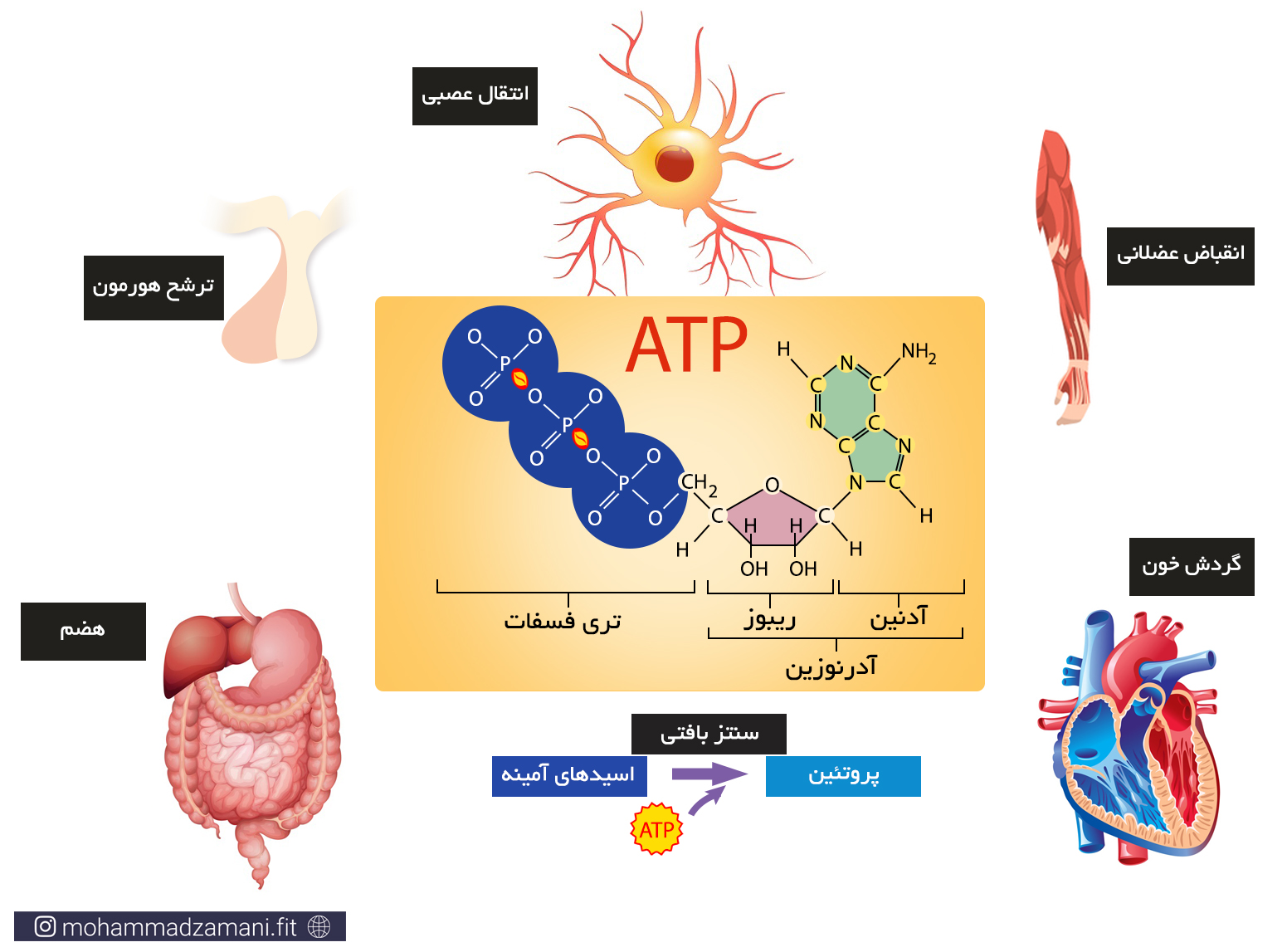
سلول هر چیزی را که برای ادامه حیات و تولید انرژی مورد نیاز خود می سوزاند، به مولکولی به نام ATP یا آدنوزین تری فسفات تبدیل می کند. درواقع ATP واحد پول درون سلول است. به این معنی که هر عملی که درون سلول انجام می شود، مانند سنتز پروتئین، انتقال پیام، عملکرد آنزیمی، انتقال مواد از غشا و ... ، در ازای آن، ATP مصرف می شود. با این تعریف، ATP حامل انرژی سلول است و هر جایی از سلول نیاز به مصرف انرژی باشد، ATP انرژی بدست آمده از سوختن مواد غذایی را با خود، به آن جا حمل می کند و در اختیار بخش های مورد نیاز قرار می دهد.
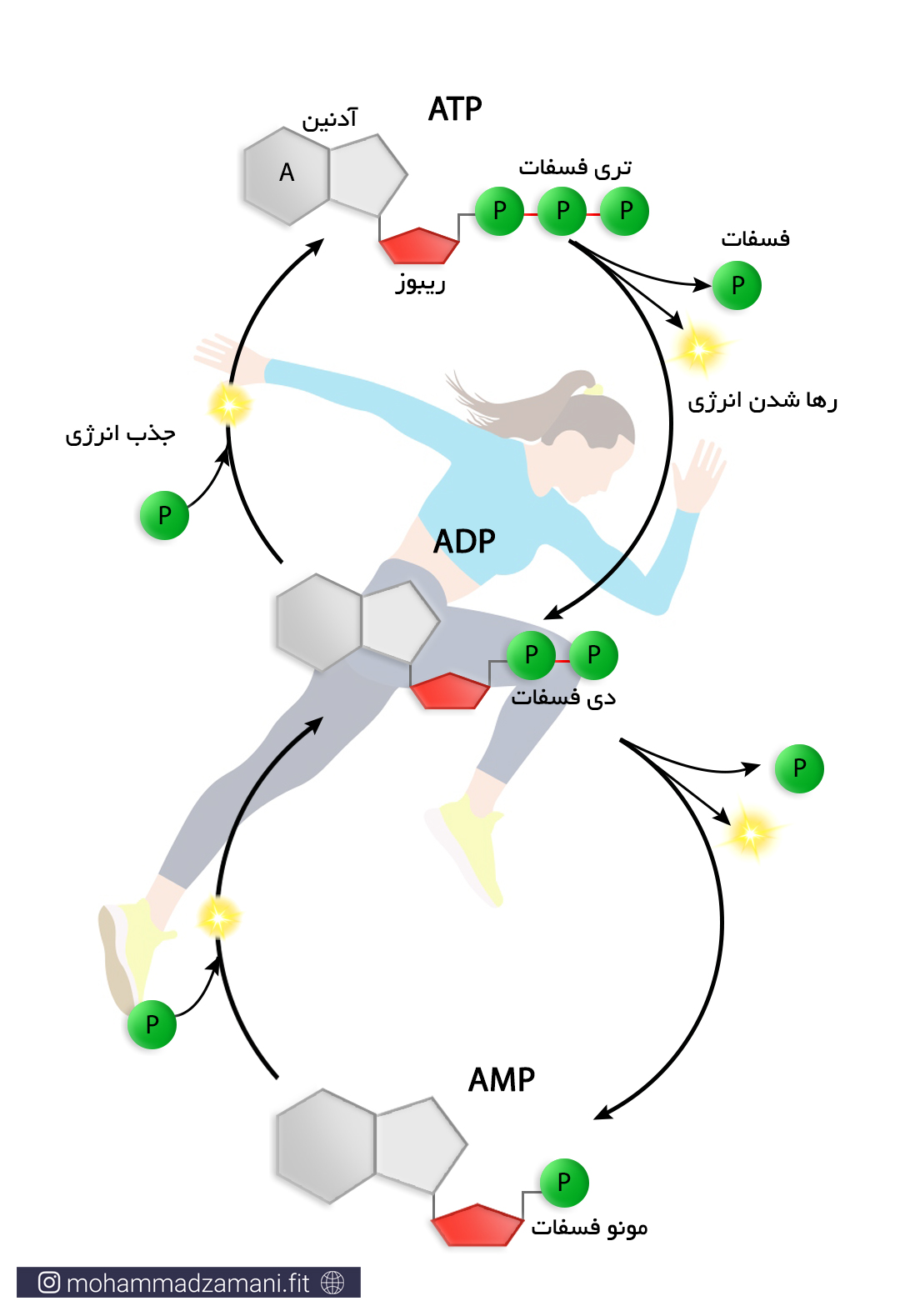
ساختار ATP
مولکول ATP، یک ساختار ترکیبی از سه مولکول ریبوز، آدنین و فسفات است که در شکل زیر شمایی از آن نشان داده شده است.
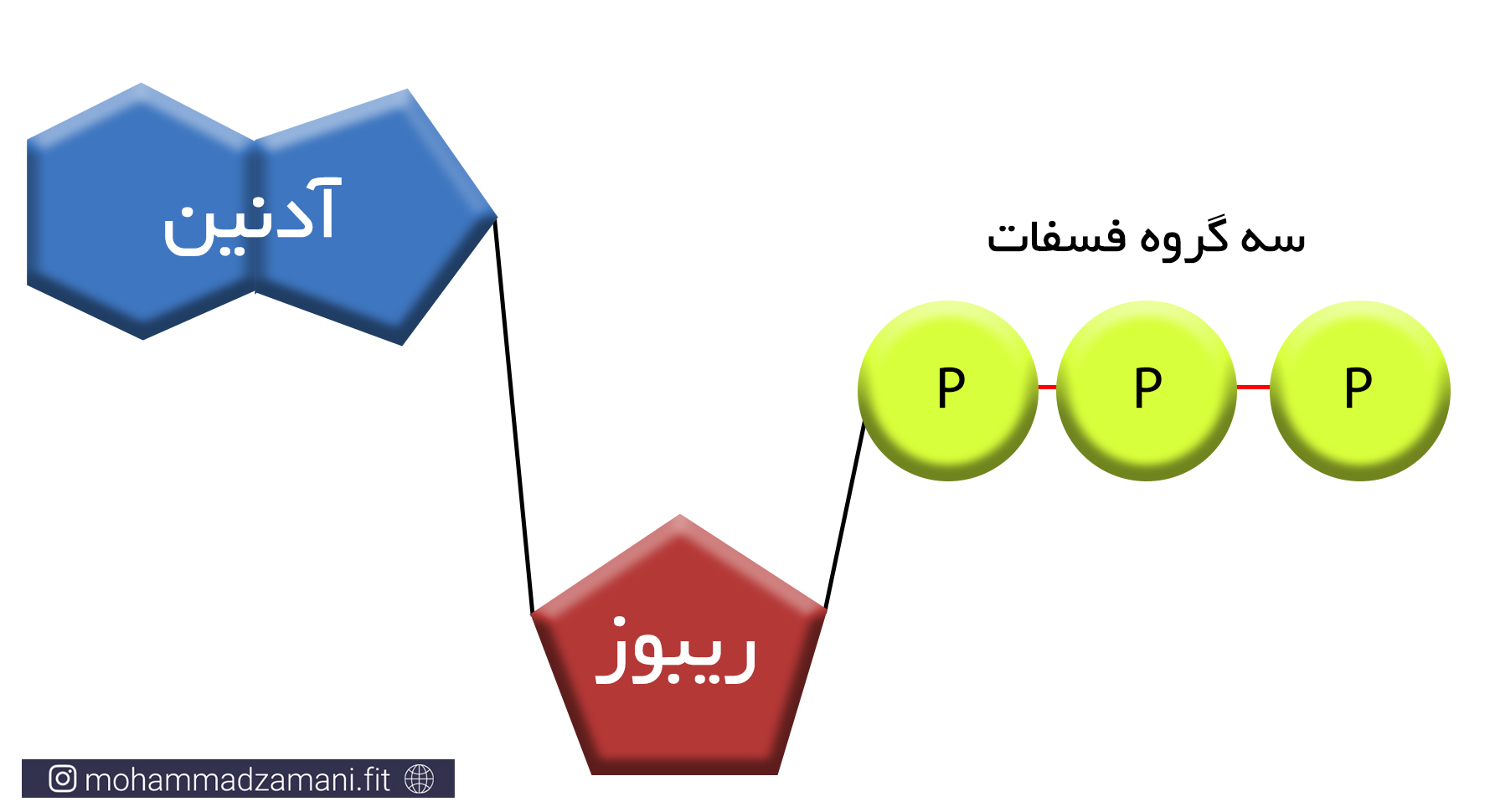
به مجموع آدنین و ریبوز، آدنوزین می گویند. آدنوزین به سه مولکول فسفات متصل است که از طریق پیوندهای بسیار پر انرژی، به یکدیگر متصل شده اند. جدا شدن هر یک از این فسفات ها، انرژی قابل توجهی آزاد می کند که می تواند نیاز سلول را در بخش های مختلف تأمین کند. جدا شدن یک گروه فسفات، ATP را به مولکولی به نام ADP یا آدنوزین دی فسفات و به همین ترتیب، جدا شدن یک فسفات دیگر، آن را به AMP یا آدنوزین مونوفسفات تبدیل می کند. این چرخه قابل بازگشت بوده و فسفات ها به همین ترتیب و با مصرف و جذب انرژی می توانند مجدد به مولکول آدنوزین مونوفسفات و آدنوزین دی فسفات متصل شوند.
فصل سوم: ATP در سلول چگونه بازسازی می شود؟
چه می آموزیم؟
بعد از معرفی ATP، بیایید به این پرسش پاسخ دهیم که ATP در سلول چگونه بازسازی می شود.
انرژی مورد نیاز برای ساخت خود ATP از کجا تأمین می شود؟
همانطور که گفته شد، انرژی مورد نیاز برای ساخت ATP از سوختن مواد غذایی درون سلول تأمین می شود. اما چگونه؟
روند تولید ATP درون سلول را اصطلاحاً سیستم انرژی می گویند. درون سلول، سه سیستم انرژی وجود دارد که از نظر توانایی و سرعت تولید ATP و همچنین، نیاز و عدم نیاز به اکسیژن باهم تفاوت دارند. در ادامه این سیستم های انرژی را به ترتیب از سریع ترین به آهسته ترین آنها معرفی می کنیم.
«سیستم های انرژی را بر اساس نیاز یا عدم نیاز به اکسیژن، به دو دسته هوازی و بی هوازی تقسیم می کنند. بر این اساس دو سیستم فسفاژن و گلیکولیز، بی هوازی و سیستم اکسیداتیو، هوازی است.»
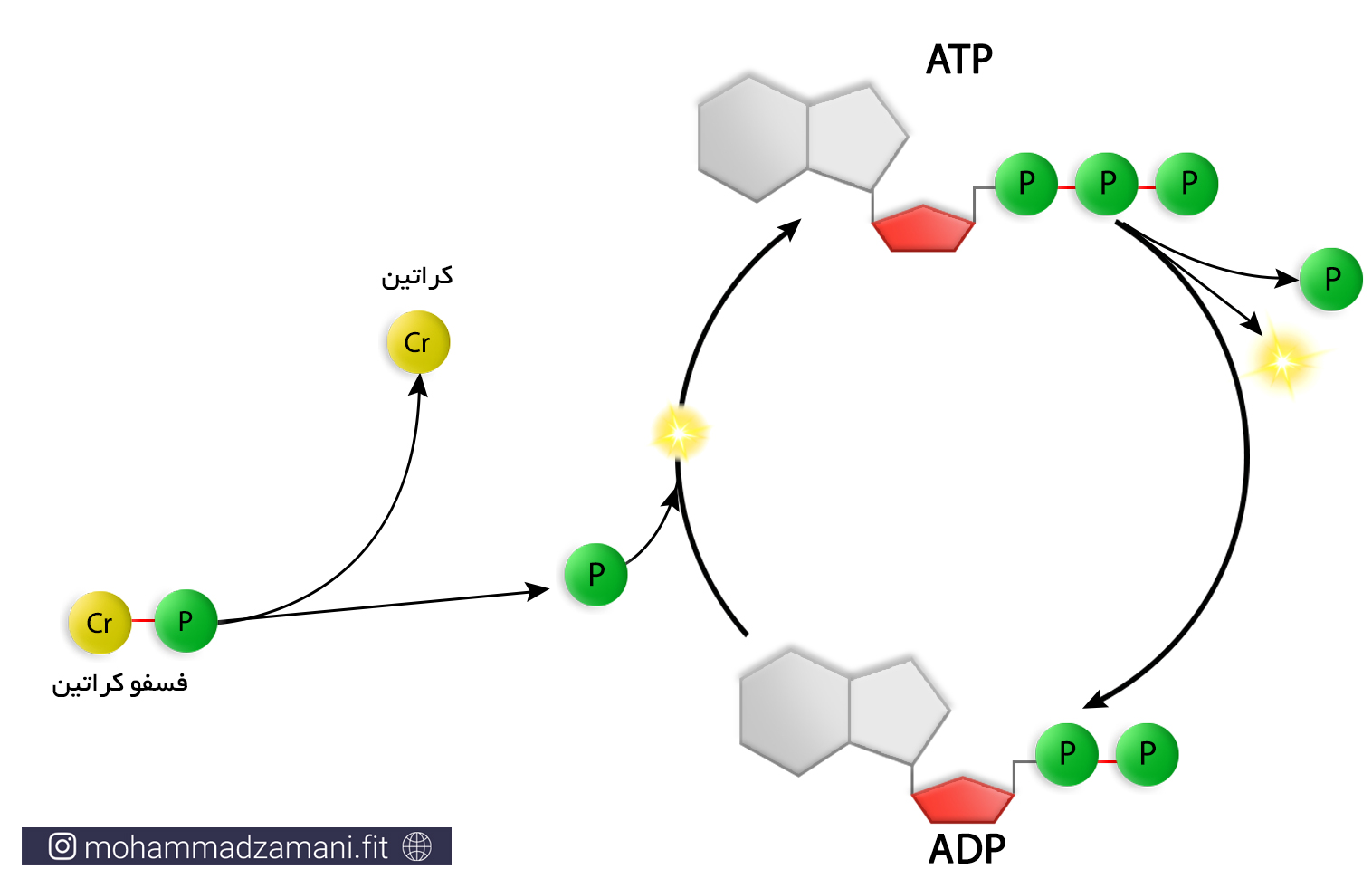
ATP-PC: سیستم انرژی فسفاژن
برای درک این سیستم انرژی، بیاید اول با مولکول PC یا فسفوکراتین –به آن کراتین فسفات نیز می گویند- آشنا شویم. فسفوکراتین، یک مولکول کراتین است که یک فسفات با پیوندی پر انرژی، مانند همان که در ATP وجود دارد، به آن متصل شده است. زمانی که یک مولکول فسفوکراتین می شکند، انرژی ای برابر انرژی مورد نیاز برای اتصال یک گروه فسفات به ADP تولید می شود. در نتیجه ADP این انرژی را مصرف می کند و ATP بازسازی می شود. این فرایند، سیستم انرژی فسفاژن نامیده می شود که با نام سیستم الاکتیک بی هوازی نیز شناخته می شود (7).
ویژگی های سیستم انرژی فسفاژن
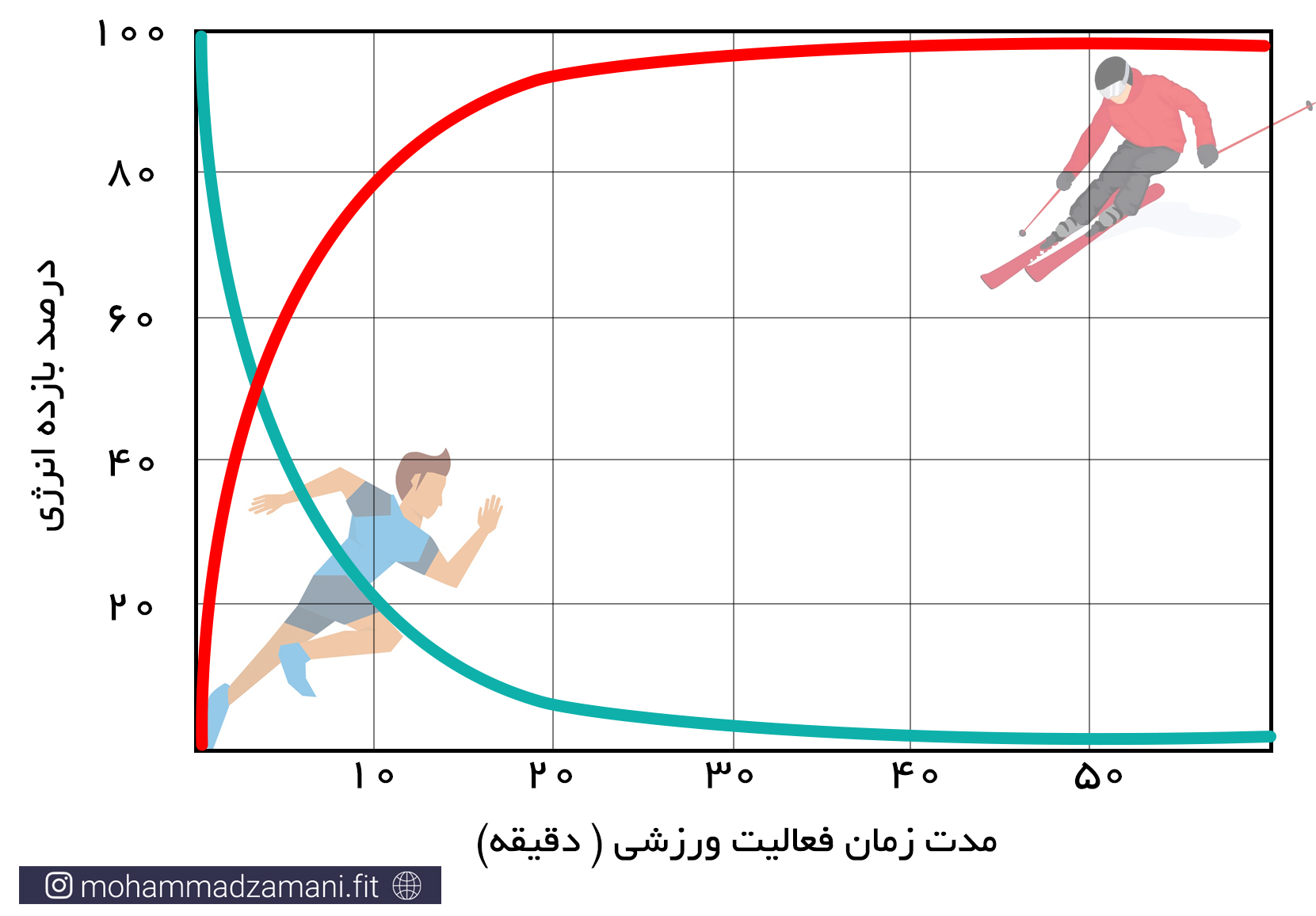
فعالیت های بدنی شدید و کوتاه مدت، مانند دوی 100 متر، شنای 25 متر یا لیفت یک وزنه سنگین، نیاز به انرژی بالا دارد که سریع در اختیار سلول قرار گیرد. این انرژی از طریق ترکیبات گروه های فسفاتی پرانرژی موجود در ذخایر ATP و PC فراهم می شود. هر کیلوگرم عضله اسکلتی، دارای 3 تا 8 میلی مول ATP و چهار تا پنج برابر این مقدار، PC است. برای یک فرد 70 کیلوگرمی، با 30 کیلوگرم توده عضلانی، این رقم برابر می شود با 570 تا 690 میلی مول فسفات پر انرژی که شامل مجموع ذخایر ATP و PC است. اگرفرض کنیم، طی یک وهله فعالیت با عضلات بزرگ، 20 کیلوگرم عضله درگیر می شود، مقدار کافی از ذخایر ATP-PC می تواند انرژی مورد نیاز یک دقیقه پیاده روی سریع، 20 تا 30 ثانیه دویدن در شروع مسابقه ماراتون یا 5 تا 8 ثانیه دویدن سریع را تأمین کند. مقدار این ترکیبات پرانرژی، احتمالاً در مدت 20 تا 30 ثانیه از هر نوع فعالیت ورزشی، می تواند به طور کامل تخلیه شود. حداکثر انرژی حاصل از سیستم انرژی فسفاژن، چهار تا هشت برابر بیشتر از متابولیسم هوازی است. برای درک بهتر این مورد، مسابقه دوی 100 متر سرعت در سطح المپیک را تصور کنید که در آن، سرعت شرکت کنندگان، رفته رفته کاهش می یابد و برنده کسی است که کاهش سرعت او دیرتر از دیگران اتفاق بیفتد (5).
«اصلی ترین ویژگی سیستم انرژی ATP-PC این است که بسیار سریع در دسترس سلول قرار می گیرد و خیلی زود تمام می شود.»
«مورد مهم دیگر اینست که سلول در حالت استراحت، معمولاً از سیستم انرژی فسفاژن استفاده نمی کند و این سیستم انرژی زمانی وارد عمل می شود که سلول به طور ناگهانی به انرژی ای بیشتر از حد پایه نیاز پیدا می کند.»

یک سؤال کلیشه ای!
دقیقاً چقدر مقدار زمان می برد تا ذخایر ATP و PC تمام شود و دقیقاً سیستم انرژی ATP-PC چه مدت می تواند نیاز انرژی سلول را تأمین کند؟
قبل از پاسخ به این سؤال، دقت داشته باشید که فعالیت هیچ یک از سیستم های انرژی در حالت معمول و در افراد سالم، هرگز متوقف نمی شود و همواره، حتی با سرعت بسیار اندک، در حال فعالیت هستند. اما در پاسخ به سؤال باید گفت که همانطور که اشاره شد، این موضوع به سرعت و شدت فعالیت بستگی دارد. در فعالیت های شدیدتر و انفجاری تر، طبیعتاً ذخایر فسفات های پر انرژی کمتر دوام می آورند. سریع ترین زمانی که ذخایر ATP و PC داخل سلول عضلانی می تواند به کمترین میزان خود برسد، بر اساس منابع مختلف، حدود 8 ثانیه است. اما برای فعالیت های سبک تر، می تواند حداکثر تا 30 ثانیه دوام بیاورد (9و8).
سیستم انرژی گلیکولیتیک بی هوازی
سیستم انرژی گلیکولیتیک بی هوازی، به نام های گلیکولیز بی هوازی، فسفوریلاسیون بی هوازی و سیستم اسیدلاکتیک نیز شناخته می شود. پیشتر اشاره شد که در کمبود ATP، در دسترس ترین سوخت برای بازسازی ATP، گلوکز است. همانطور که از نام آن پیداست، سیستم انرژی گلیکولیز بی هوازی، بدون نیاز به اکسیژن، می تواند ATP را بازسازی کند. در این سیستم انرژی، مولکول گلوکز طی چند مرحله واکنش، به 2 مولکول پیروات تبدیل شده و در این مسیر، در مجموع، 4 مولکول ATP تولید می کند. از آنجایی که در بخشی از این سلسله واکنش ها، 2 مولکول ATP مصرف می شود، در نتیجه تولید خالص مسیر گلیکولیز بی هوازی به ازای هر مولکول گلوکز، 2 مولکول ATP است.
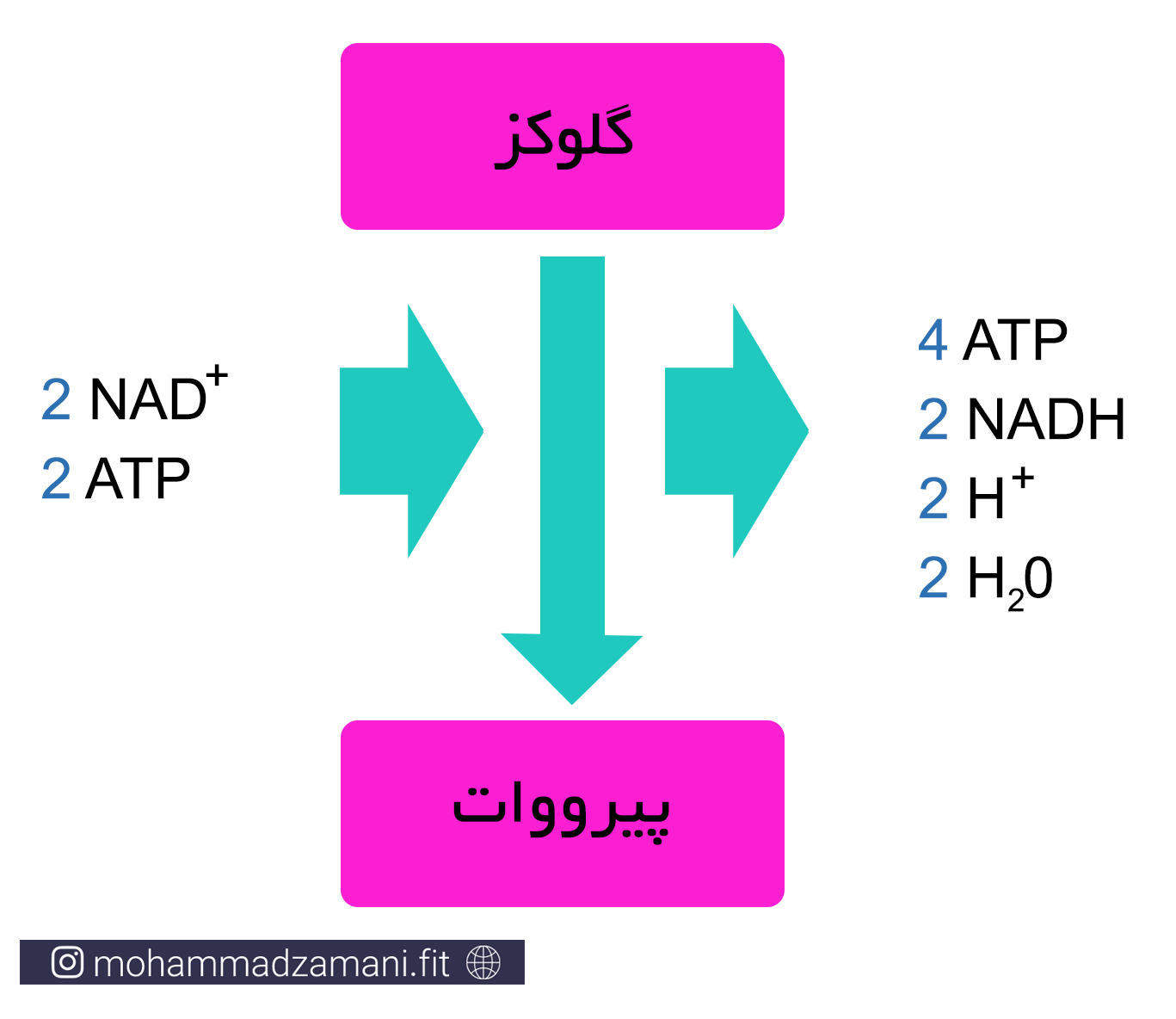
ویژگی های سیستم انرژی گلیکولیتیک بی هوازی
مانند فسفاژن، سیستم انرژی گلیکولیتیک بی هوازی نیز، یک سیستم انرژی سریع است و در شرایط عدم دسترسی سلول به اکسیژن کافی، انرژی مورد نیاز برای تجدید ATP را تأمین می کند. این سیستم انرژی از اولین لحظات تا پایان فعالیت ورزشی، درگیر می شود. اما از ثانیه 10 تا دقیقه 2 فعالیت، بویژه در فعالیت های انفجاری شدید، مانند دوی 400 متر یا شنای 100 متر، سیستم انرژی غالب برای بازتولید ATP است. همچنین در آخرین لحظات دو های استقامت، که ورزشکاران سرعت خود را افزایش می دهند، بخش عمده تولید انرژی را سیستم گلیکولیز بی هوازی به عهده می گیرد.
توجه!
واکنش های مربوط به هر دو سیستم انرژی فوق، یعنی فسفاژن و گلیکولیتیک بی هوازی، در سیتوزول سلول و در غیاب اکسیژن اتفاق می افتد. به همین دلیل، به مجموع این دو سیستم انرژی، سیستم انرژی بی هوازی می گویند.
سیستم انرژی هوازی
در نقطه مقابل دو سیستم انرژی بالا، که بدون استفاده از اکسیژن، ATP را بازسازی می کنند، سیستم انرژی هوازی قرار داد که همانطور که از نام آن پیداست، فعالیت آن به حضور اکسیژن کافی وابسته است. همچنین برخلاف دو سیستم انرژی قبل، ظرفیت تولید انرژی از طریق سیستم انرژی هوازی، بسیار بالاست و تا زمانی که اکسیژن و سوخت اولیه در دسترس باشد، این سیستم انرژی می تواند به فعالیت خود ادامه دهد.
سلسله واکنش هایی که طی سیستم انرژی هوازی برای بازسازی ATP اتفاق می افتد، با نام فسفوریلاسیون اکسیداتیو شناخته می شود. به همین علت، به سیستم انرژی هوازی، فسفوریلاسیون اکسیداتیو نیز می گویند. سوبسترای (ماده) مورد نیاز برای این سیستم، می تواند هر سه مولکول گلوکز، اسیدآمینه و اسید چرب باشد که طی فرآیندی نسبتاً پیچیده، ATP را بازسازی می کند.
سیستم انرژی هوازی، از سه مرحله پیاپی تشکیل شده است که عبارتند از: گلیکولیز یا بتا اکسیداسیون (بسته به اینکه سوبسترای اولیه گلوکز باشد یا اسید چرب)، چرخه کربس و زنجیره انتقال الکترون. در ادامه هریک از این مراحل را به طور مجزا بررسی می کنیم.
گلیکولیز
اگر با اصول نامگذاری فرآیندهای شیمیایی آشنا باشید، متوجه می شوید که گلیکولیز، به معنای فرآیند تجزیه گلوکز است. در این فرآیند، گلوکز یا گلیکوژن، طی چند مرحله واکنش، تجزیه شده و دو مولکول پیرووات تولید می کند.
بیشتر بدانیم
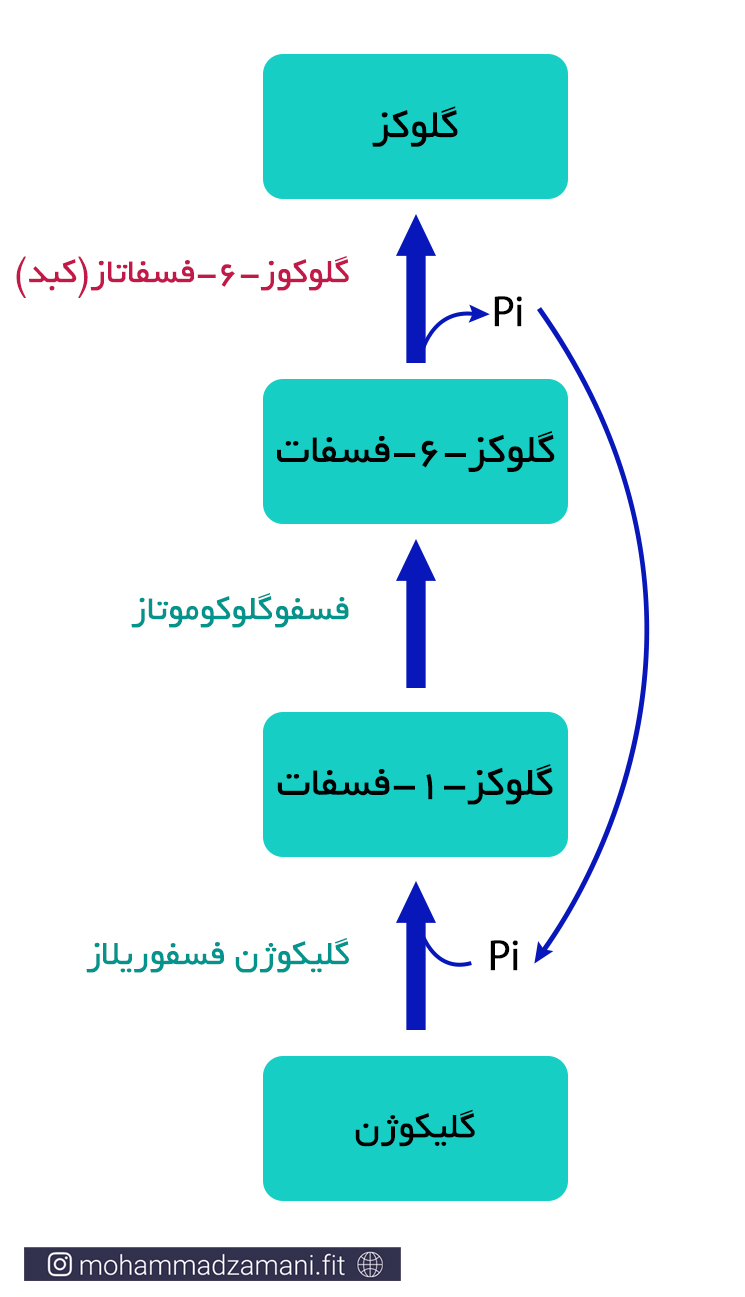
درون بیشتر سلول ها، از جمله سلول های کبد و عضلات اسکلتی، گلوکز به شکل آزاد وجود ندارد. بلکه به ترکیب پیچیده تری، به نام گلیکوژن تبدیل شده و به این صورت درون سلول ذخیره می شود. در واقع گلیکوژن زنجیره ای بهم پیوسته از 2000 تا 6000 مولکول گلوکز است و در هر بار واکنش سنتز آن، یک گلوکز دیگر به آن اضافه می شود. فرآیند ترکیب مولکول های گلوکز و تبدیل آن به گلیکوژن، به شکل زیر است:

درون سلول های عضلانی، زمانی که نیاز به انرژی افزایش می یابد، یکی از اولین رویداد ها، تجزیه گلیکوژن و جدا شدن واحد های گلوکز، برای شروع روند گلیکولیز و تولید ATP است. به این فرایند گلیکوژنولیز می گویند که به این صورت انجام می شود:
تاریخچه
مسیر کامل گلیکولیز نزدیک به یک قرن است که شناخته شده است. اما جالب است بدانید که اولین گام ها برای درک فرآیند گلیکولیز، در صنعت شراب سازی و برای درک روند الکلی شدن نوشیدنی ها، به منظور ارتقای کیفیت نوشیدنی ها برداشته شد. لوئی پاستور ( Louis Pasteur) معروف، اولین کسی بود که در زمینه فرآیند تخمیر قند تحقیق کرد (دهه 1850). مطالعات او توسط ادوارد بوچنر (Eduard Buchner)، آرتور هاردن (Arthur Harden) و ویلیام یانگ (William Young) ادامه یافت و تا دهه 1910 گام های زیادی از فرآیند گلیکولیز شناخته شد. در دهه 1920، اتو میرهاف (Otto Meyerhof) توانست نتایج تحقیقات گذشته را یکجا جمع کند و در کنار آن، برای اولین بار آنزیم های مختلف مسیر گلیکولیز را در بافت عضلانی کشف کند. وی در نهایت موفق شد مراحل تبدیل گلیکوژن به اسیدلاکتیک را کامل کند. با این حال گام هایی در این بین جا افتاده بود که در دهه های بعد با همکاری گوستاو امبدن (Gustav Embden) با میرهاف، امبدن و بیوشیمیست های دیگر، کشف و پازل کامل شده آن بالاخره در دهه 1940 منتشر شد (14).
نکته قابل توجه این است که چنانچه برای فرآیند گلیکولیز، از گلوکز به عنوان سوخت اولیه استفاده شود، نسبت به زمانی که از گلیکوژن استفاده می شود، یک مولکول ATP مصرف می شود و در نتیجه تعداد نهایی ATP تولیدی از کل فرایند، یک مولکول کمتر خواهد بود.
فرایند گلیکولیز به صورت زیر انجام می شود:
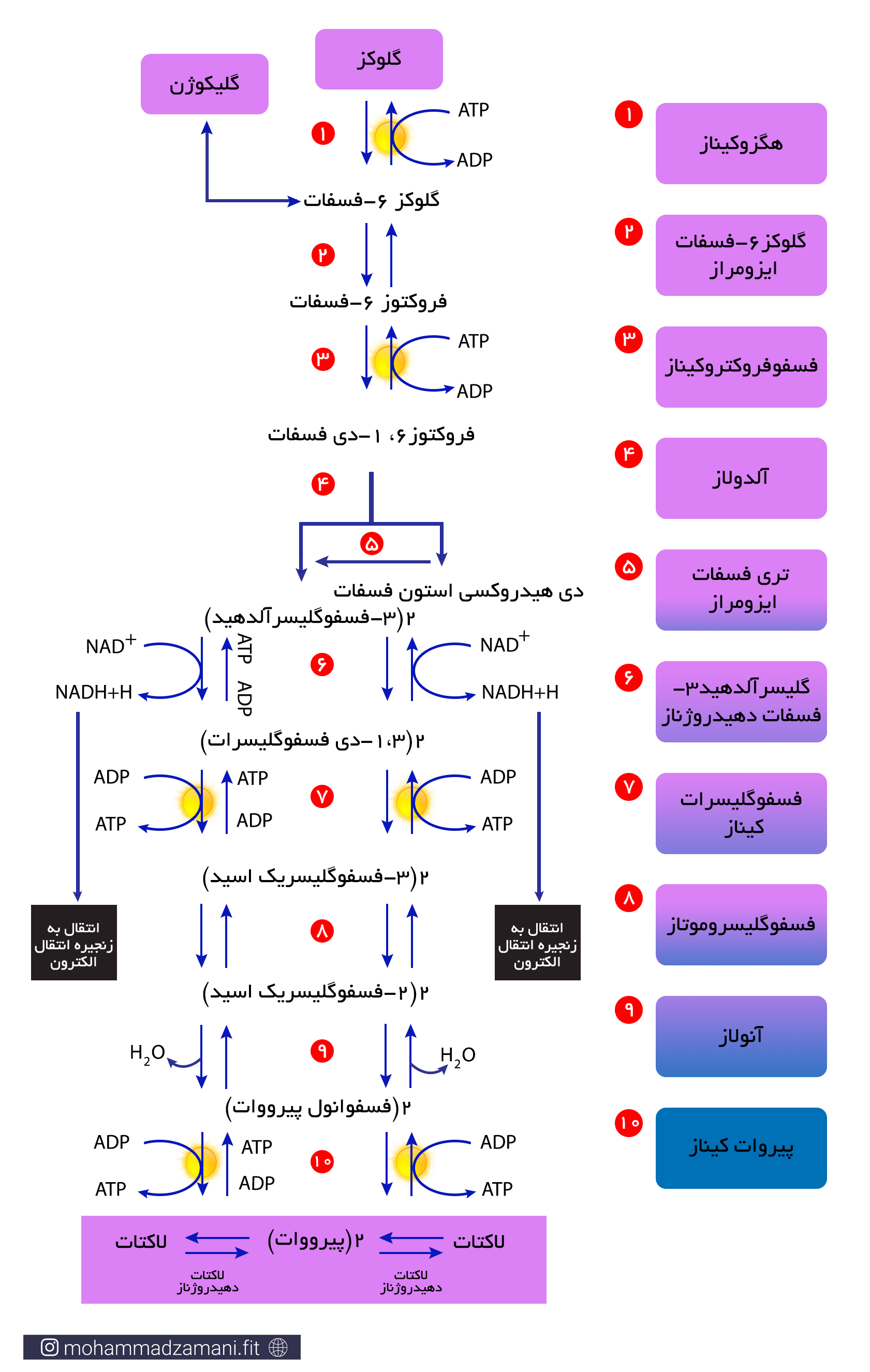
همانطور که می بینید، در طی فرایند گلیکولیز، یک مولکول 6 کربنه گلوکز، به دو مولکول 3 کربنه پیروات تبدیل می شود که در شرایط کمبود اکسیژن، تبدیل به لاکتات می شود. تجمع لاکتات در سلول های عضلانی می تواند پاسخ هایی را ایجاد کند که آشنا ترین آن برای ورزشکاران حس سوزش در عضلات در حین تمرین است که با چند ثانیه توقف فعالیت و استراحت رفع می شود. این توقف فعالیت، باعث می شود که علاوه بر کاهش یا حتی توقف تولید لاکتات، جریان خون عضله افزایش یابد و لاکتات تجمع یافته در بافت توسط جریان خون جمع شده و دفع شود.
چنانچه، اکسیژن در دسترس سلول به میزان کافی وجود داشته باشد، پیروات وارد دومین مرحله از سیستم انرژی هوازی می شود که در ادامه به آن می پردازیم.
چرخه کربس
همانطور که گفته شد، فرایند گلیکولیز در سیتوزول سلول انجام می شود و در ادامه، پیرووات تولیدی از آن، از سیتوزول وارد میتوکندری شده و ادامه فرآیند های شیمیایی تا اتمام روند و تولید ATP، درون میتوکندری انجام می شود.
تاریخچه
هانس آدولف کربس ( Hans Adolf Krebs) به همراه همکار خود، ویلیام جانسون که در دهه 1930، در دانشگاه شفیلد، فرآیند تنفس سلول را مطالعه می کردند، چرخه اسیدسیتریک را کشف و معرفی کردند که امروزه با نام چرخه تری کربوکسیلیک (TCA) شناخته می شود و به افتخار کاشف آن، این چرخه را، چرخه کربس نیز می نامند (11). کربس، در سال 1953، به دلیل کشف و تکمیل چرخه اسیدسیتریک، موفق به دریافت جایزه نوبل فیزیولوژی یا پزشکی شد (12).
در شکل زیر واکنش های مربوط به چرخه کربس و روند آن را مشاهده می کنید.
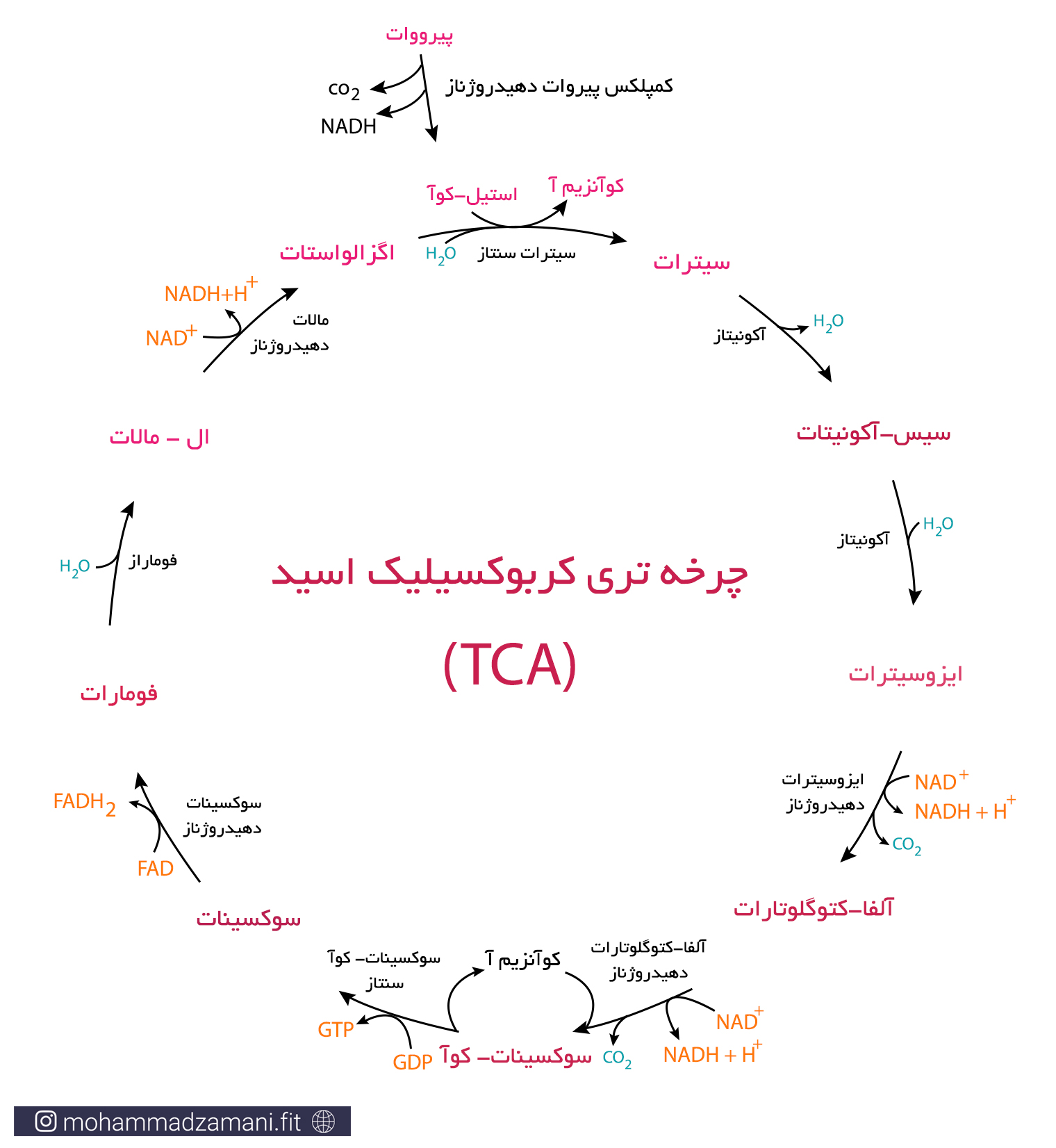
پیرووات تولیدی در گلیکولیز، با ازدست دادن یک کربن در قالب CO2 و همراه با تولید NADH، به استیل-کوآ 2 کربنه تبدیل می شود. با ترکیب استیل-کوآ با مولکول 4 کربنه اگزالواستات، چرخه کربس شروع می شود. مطابق شکل، در این چرخه اگزالواستات، پس از 9 مرحله واکنش بازسازی می شود و در طی این فرآیند، 3 مولکول NADH، 1 مولکول FADH2، 1 مولکول GTP و 2 مولکول CO2 تولید می شود. با توجه به این که با وارد شدن هر مولکول گلوکز به فرآیند گلیکولیز، دو مولکول پیرووات تولید شده و چرخه TCA دو بار انجام می شود، محصول نهایی برابر خواهد بود با:
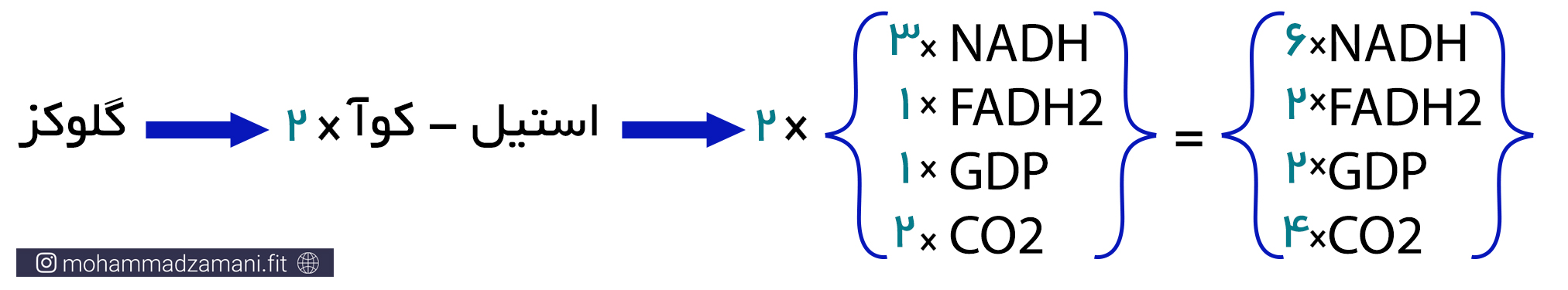
مولکول GTP (گوانین تری فسفات) یک ترکیب پرانرژی، دقیقاً مانند ATP است که در ساختار آن بجای آدنوزین، گوانین قرار گرفته است. بنابراین تولید یک مولکول GTP در چرخه کربس را، معادل یک ATP به حساب می آورند. بنابراین، با در نظر گرفتن این که از هر مولکول گلوکزی که وارد مسیر سوخت می شود، دو چرخه کربس به راه می افتد، تولید ATP به ازای هر مولکول گلوکز، از چه کربس، برابر خواهد بود با دو مولکول ATP، که با در نظر گرفتن دو ATP دیگری که در خود مسیر گلیکولیز تولید می شود، محصول نهایی تا این مرحله از سوخت گلوکز، معادل 4 مولکول ATP خواهد بود.
«دقت کنید که اگر سوخت اولیه، گلیکوژن باشد، محصول نهایی، 5 مولکول ATP خواهد بود.»
چرخه ای از 9 واکنش تنها برای یک مولکول ATP؟
در واقع، اهمیت چرخه کربس، به خاطر تولید مستقیم ATP نیست. بلکه مهم ترین تولیدات آن، مولکول های NADH و FADH2 هستند که در سومین مرحله از سیستم انرژی هوازی با اهمیت این دو مولکول آشنا خواهید شد. اما قبل از آن بیایید ببینیم، چنانچه سلول، بجای قند، چربی بسوزاند، روند چگونه خواهد بود؟
فرایند سوخت اسید چرب
چربی، اصلی ترین سوخت بسیاری از سلول های بدن، از جمله سلول های عضلانی است. به طوری که در بیشتر فعالیت های بدنی روزانه، عضلات برای تأمین انرژی مورد نیاز خود، عمدتاً از چربی استفاده می کنند. بیایید ببینیم چربی چگونه درون سلول می سوزد و انرژی تولید می کند.
انتقال اسید چرب به میتوکندری
برخلاف گلوکز که بخشی از فرایند سوخت آن در سیتوزول اتفاق می افتد، کل فرایند سوختن اسید چرب، در میتوکندری انجام می شود. اما اسید چرب، به دلیل بار منفی همنامی که با انواع غشاهای فسفولیپیدی، از جمله غشای میتوکندری دارد، نمی تواند از آن عبور کند و وارد میتوکندری شود. بنابراین، قبل از ورود به میتوکندری، با اتصال به یک مولکول کوآنزیم آ و مصرف یک مولکول ATP، طی فرمول زیر فعال می شود:

مولکول آسیل چرب-کو آ بدست آمده از واکنش بالا می تواند با اتصال به حامل خود در غشای بیرونی و غشای درونی میتوکندری، به دورن آن راه پیدا کند. حامل مورد نظر در غشای بیرونی میتوکندری، کارنیتین پالمیتوئیل ترانسفراز1 (CPT I) و در غشای درونی میتوکندری، کارنیتین پالمیتوئیل ترانسفراز 2 (CPT II) می باشد. در شکل زیر، روند فعال شدن اسید چرب و انتقال آن به میتوکندری، به شکل شماتیک آورده شده است.
- نکته
کارنیتین پالمیتوئیل ترانسفراز با نام های دیگری، شامل کارنیتین آسیل ترانسفراز (CAT)، کوآ: کارنیتین آسیل ترانسفراز (CCAT) و پالمیتوئیل-کوآ ترانسفراز نیز شناخته می شود.
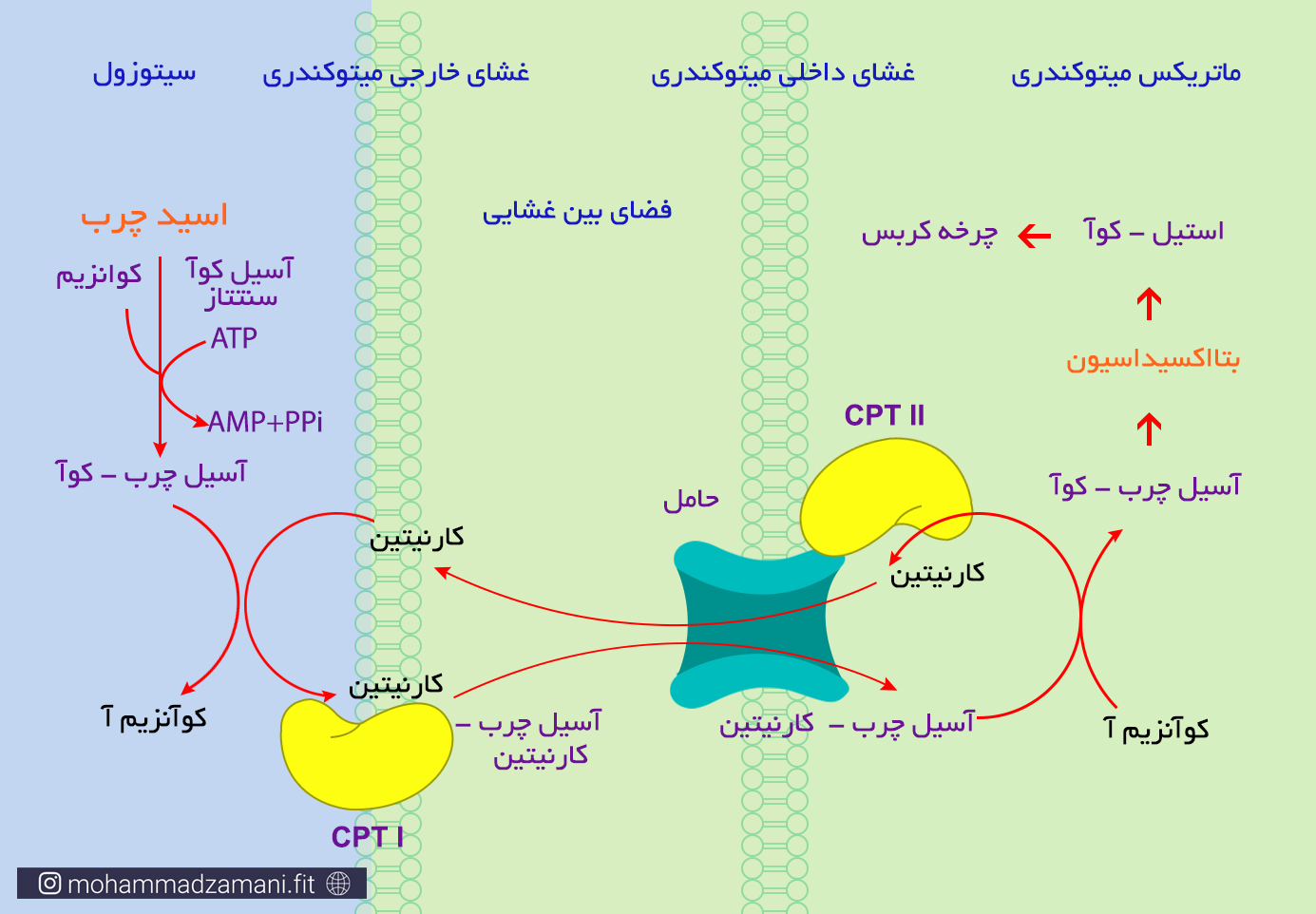
همانطور که در شکل نیز کاملاً مشخص است، آنچه وارد میتوکندری شده و فرایند بتااکسیداسیون را آغاز می کند، شکل تغییر یافتهای از اسید چرب، به نام آسیل چرب-کوآ است.
بتا اکسیداسیون
آسیل چرب-کوآ، پس از ورود به میتوکندری، فرایندی مانند گلیکولیز را طی می کنند که طی آن تبدیل به استیل-کوآ شده و وارد چرخه کربس می شود. به این فرایند بتا اکسیداسیون می گویند. برخلاف گلیکولیز، بتا اکسیداسیون برای انجام، نیاز به حضور اکسیژن دارد و در نبود اکسیژن، روند آن در سلول متوقف می شود.
فرایند بتااکسیداسیون، شامل 4 مرحله واکنش متوالی است که طی آن از آسیل چرب-کوآ یک مولکول دو کربنه استیل-کوآ جدا شده و یک مولکول آسیل چرب-کوآ، با دو کربن کمتر باقی می ماند و طی این فرآیند، یک مولکول NADH و یک مولکول FADH2 تولید می شود. آسیل چرب-کوآ تولید شده، مجدداً وارد فرایند بتااکسیداسیون می شود و این روند تا جایی ادامه می یابد که واحدهای دوکربنه استیل-کوآ، کاملاً جدا شده و در آخرین مرحله، دو مولکول استیل-کوآ باقی بماند.
«اسیدهای چرب اشباع وارد شونده به فرآیند بتااکسیداسیون در انسان، دارای تعداد کربن زوج هستند؛ مانند پالمیتولئیک اسید که 16 کربن دارد. اسیدهای چرب دارای تعداد کربن فرد، در سلول های گیاهی و در جوندگان یافت می شوند.»
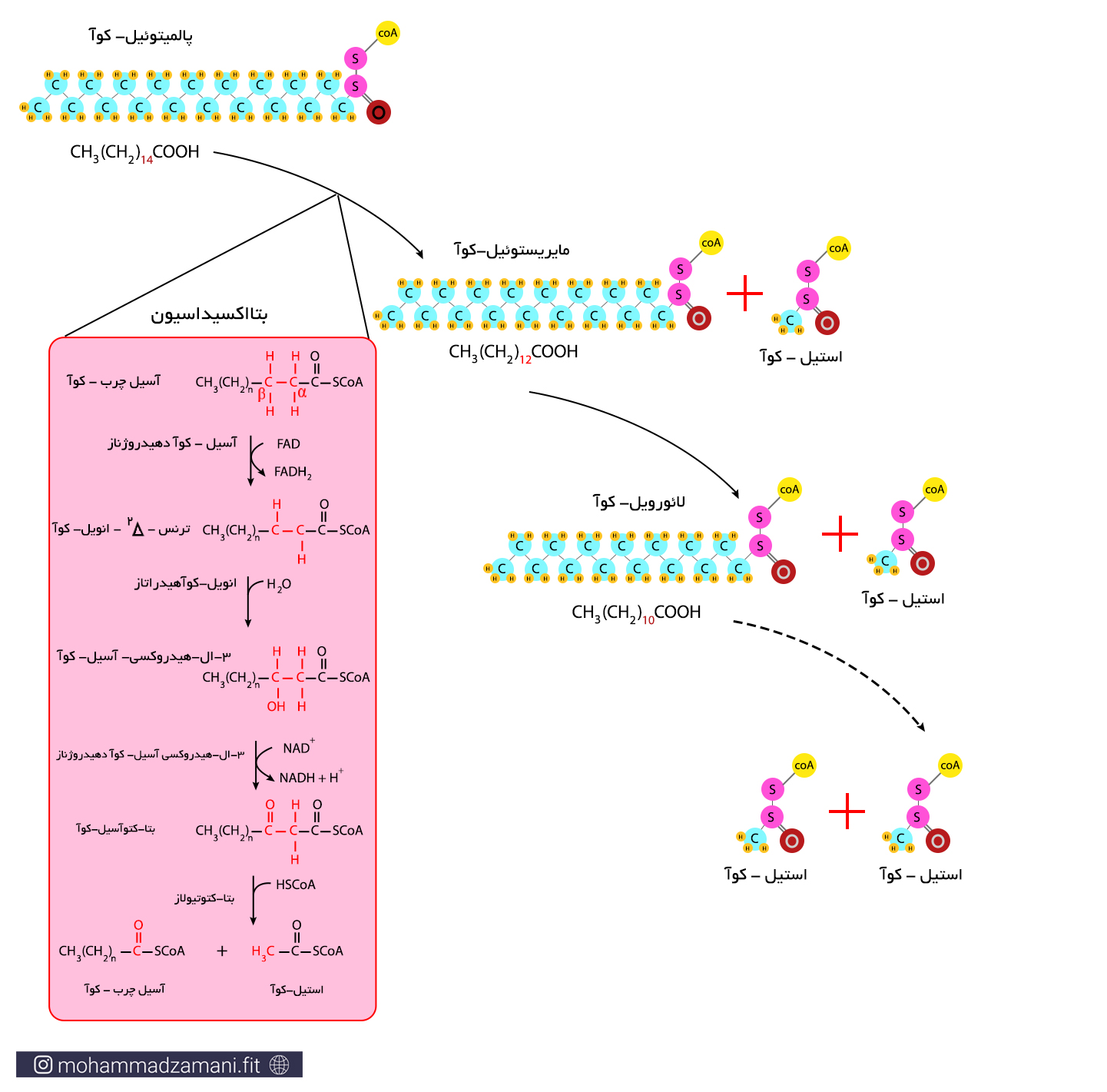
مولکول های استیل-کوآ تولید شده از فرایند بتااکسیداسیون، وارد چرخه کربس شده و به ازای هر چرخه، یک مولکول ATP (GTP)، 3 مولکول NADH و یک مولکول FADH2 تولید می شود. برخلاف گلیکولیز، بتااکسیداسیون، تولید مستقیم ATP ندارد، اما مقدار قابل توجهی NADH و FADH2 تولید می کند. هم در گلیکولیز، هم چرخه کربس و هم در فرایند بتااکسیداسیون، این دو مولکول تولید می شوند. اما تولید آن ها چه اهمیتی دارد؟ جواب این سؤال در آخرین مرحله از سیستم انرژی هوازی نهفته است.
چرخه انتقال الکترون
آخرین مرحله از سیستم انرژی هوازی، چرخه انتقال الکترون یا زنجیره انتقال الکترون است. قبل از این که به عملکرد این چرخه بپردازیم، بیایید ببینیم چرخه انتقال الکترون چیست.
زنجیره انتقال الکترون از پنج مولکول بزرگ پروتئینی تشکیل شده است که به هریک از آن ها، کمپلکس پروتئینی می گویند. این کمپلکس ها، به ترتیب از یک تا پنج نامگذاری شده اند که با شماره لاتین شماره گذاری می شوند. این کمپلکس ها، در غشای داخلی میتوکندری قرار گرفته اند و همانطور که در شکل مشاهده می کنید، طی فرایندی چند مرحله ای از انتقال پروتون- به شکل اتم هیدروژن- در عرض غشا، نیروی لازم برای بازسازی ATP را فراهم می کند. در ادامه، این روند با جزئیات توضیح داده می شود.
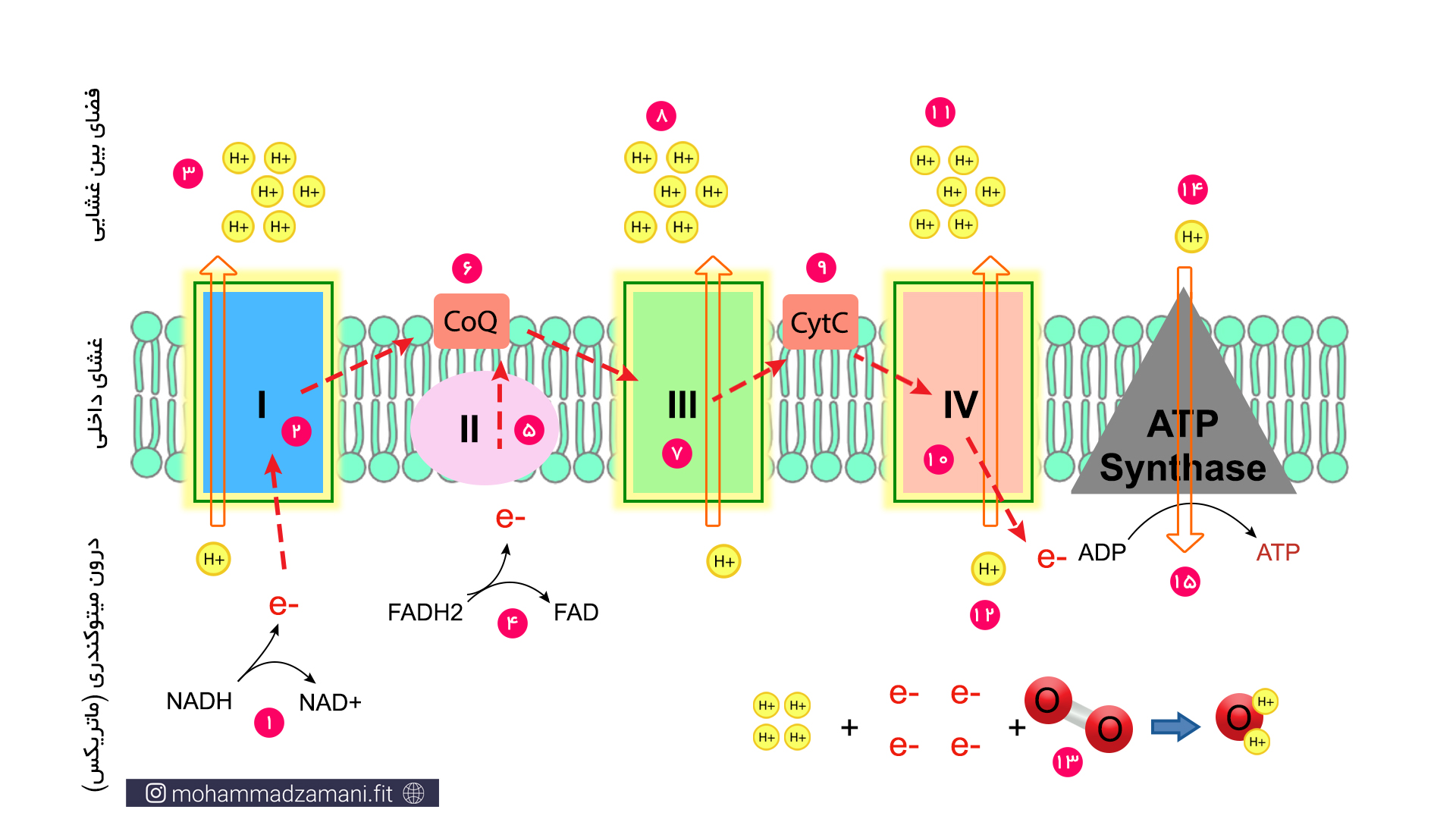
در شکل بالا می توانید مراحل مختلف چرخه انتقال الکترون را مشاهده کنید. فرایند های چرخه به ترتیب شماره، به صورت زیر می باشد:
- در اولین مرحله از چرخه، NADH که از واکنش های مراحل قبل تر تولید شده بود، خود را به کمپلکسI می رساند و الکترون خود را به کمپلکسI می دهد و تبدیل به NAD+ می شود.
- الکترون به کمپلکسI منتقل شده و باعث افزایش بار الکتریکی آن می شود.
- بار الکتریکی کمپلکسI، باعث فعال شدن پمپ هیدروژن شده و اتم های هیدروژن آزاد را از درون میتوکندری به فضای بین غشایی پمپ می کند.
- در مراحل قبل تر سیستم انرژی، مولکول دیگری به نام FADH2 نیز تولید می شد که مانند NADH، یک ناقل الکترون است. مولکول FADH2 نیز پس از گرفتن الکترون از مراحل قبل، خود را به زنجیره انتقال الکترون می رساند. اما الکترون خود را به کمپلکسII تحویل می دهد و تبدیل به FAD می شود.
- کمپلکسII، الکترون را از FADH2 تحویل می گیرد. اما برخلاف کمپلکسI، بدون واکنش خاصی، آن را به کوآنزیم Q تحویل می دهد که در شکل با نام CoQ نشان داده شده است.
- کوآنزیم Q، الکترون ها را هم از کمپلکسI و هم از کمپلکسII تحویل می گیرد و به کمپلکسIII تحویل می دهد.
- کمپلکسIII الکترون ها را از کوآنزیم Q تحویل می گیرد و بار الکتریکی آن افزایش می یابد.
- درست مانند کمپلکسI، کمپلکسIII نیز یک پمپ هیدروژنی است که با گرفتن بار منفی فعال شده و هیدروژن ها را از فضای داخل میتوکندری به فضای بین غشایی پمپ می کند.
- در مرحله بعدی، سیتوکرومC، که با نام CytC در شکل نشان داده شده است، الکترون ها را از کمپلکسIII تحویل می گیرد و به کمپلکسIV منتقل می کند.
- کمپلکسIV الکترون ها را از سیتوکرومC تحویل می گیرد و بار الکتریکی آن افزایش می یابد.
- مانند کمپلکسIII و کمپلکسI، کمپلکسIV نیز یک پمپ هیدروژن است که با شارژ شدن الکتریکی بوسیله دریافت الکترون فعال شده، هیدروژن های آزاد را از فضای درون میتوکندری به فضای بین غشایی پمپ می کند.
- پذیرنده بعدی و نهایی الکترون در این زنجیره، اکسیژن است که الکترون را از کمپلکسIV تحویل می گیرد.
- اکسیژن در فضای داخل میتوکندری و به شکل مولکول اکسیژن که از دو اتم اکسیژن ساخته شده است، قرار دارد. چهار الکترون به همراه چهار اتم هیدروژن و یک مولکول اکسیژن واکنش داده و دو مولکول آب تولید می کند.
- پمپ پروتون به بیرون باعث ایجاد اختلاف بار الکتریکی در دو سمت غشا شده و این اختلاف بار باعث فعال شدن پنجمین کمپلکس می شود. پنچمین کمپلکس یک کانال یک طرفه برای عبور پروتون ها از فضای بین غشایی به فضای داخل میتوکندری است.
- کمپلکس V علاوه بر کانال، یک آنزیم سنتز پروتئین با نام ATP سنتاز نیز هست که انرژی حاصل از کاهش اختلاف بار الکتریکی در اثر عبور پروتون ها را مصرف می کند و ADP را به ATP تبدیل می کند.
نکته: به مولکول های NADH و FADH2 ناقل الکترون می گویند که وظیفه دارند الکترون را از فرایند های گلیکولیز، چرخه کربس و زنجیره انتقال الکترون دریافت کنند و به زنجیره انتقال الکترون تحویل دهند.
بیشتر بدانیم
محاسبه ATP تولیدی از مسیرهای تولید انرژی
برای محاسبه تعداد ATP بدست آمده از مسیر های مختلف انرژی، باید مجموع ATPهای تولید شده به صورت مستقیم و ATP های بدست آمده از زنجیره انتقال الکترون محاسبه شود. به این منظور باید بدانیم به ازای هر ناقل الکترون، چند ATP در زنجیره انتقال الکترون بدست می آید.
در زنجیره انتقال الکترون، به ازای هر مولکول NADH، معادل 2.5 مولکول ATP و به ازای هر مولکول FADH2، معادل 1.5 مولکول ATP تولید می شود.
در جدول زیر، ATP های بدست آمده از متابولیسم هوازی یک مولکول گلوکز، به تفکیک مراحل محاسبه شده است.
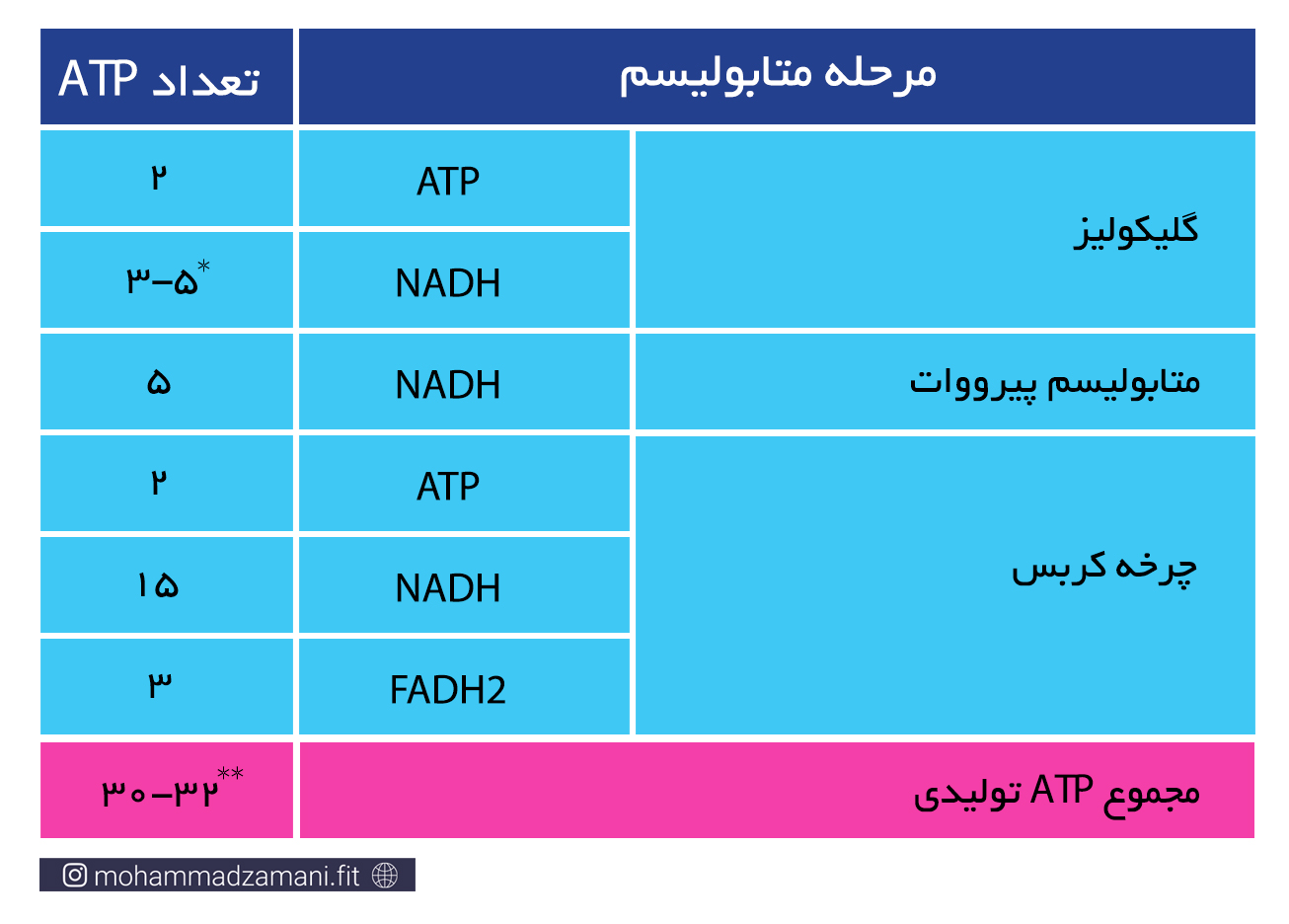
* از مراحل بالا، گلیکولیز در سیتوزول و مابقی درون میتوکندری انجام می شود. هر مولکول گلوکز که وارد فرآیند گلیکولیز می شود، علاوه بر تولید دو مولکول ATP، دو مولکول NADH نیز تولید می کند. همانطور که گفته شد، NADH یک حامل الکترون است که باید خود را به چرخه انتقال الکترون برساند. اما NADH نمی تواند به تنهایی از غشای میتوکندری عبور کند و برای ورود به میتوکندری نیاز دارد که به حامل تخصصی خود بچسبد. به این حامل ها، اصطلاحاً شاتل می گویند. دو نوع شاتل تخصصی برای انتقال الکترون از سیتوزول به میتوکندری وجود دارد؛ گلیسرول 3-فسفات و مالات-آسپارتات. شاتل مالات-آسپارتات، به ازای هر NADH که به آن می چسبد، یک مولکول NADH وارد میتوکندری می کند. اما شاتل گلیسرول 3-فسفات، الکترون را به صورت FADH2 وارد میتوکندری می کند. بنابراین، اگر هر دو NADH تولید شده در فرایند گلیکولیز، بوسیله شاتل مالات-آسپارتات وارد میتوکندری شوند، در نهایت 5 مولکول ATP و اگر با شاتل گلیسرول 3-فسفات وارد میتوکندری شوند، در نهایت 3 مولکول ATP تولید خواهند کرد. از آنجایی که ممکن است هر NADH تولید شده شاتل های مختلف وارد میتوکندری شوند، بنابراین تعداد ATP تولیدی از NADH حاصل از گلیکولیز، می تواند 3 تا 5 عدد باشد.
** دقت داشته باشید که اگر شروع مراحل از گلیکوژن باشد، یک مولکول ATP به مجموع آن اضافه خواهد شد.
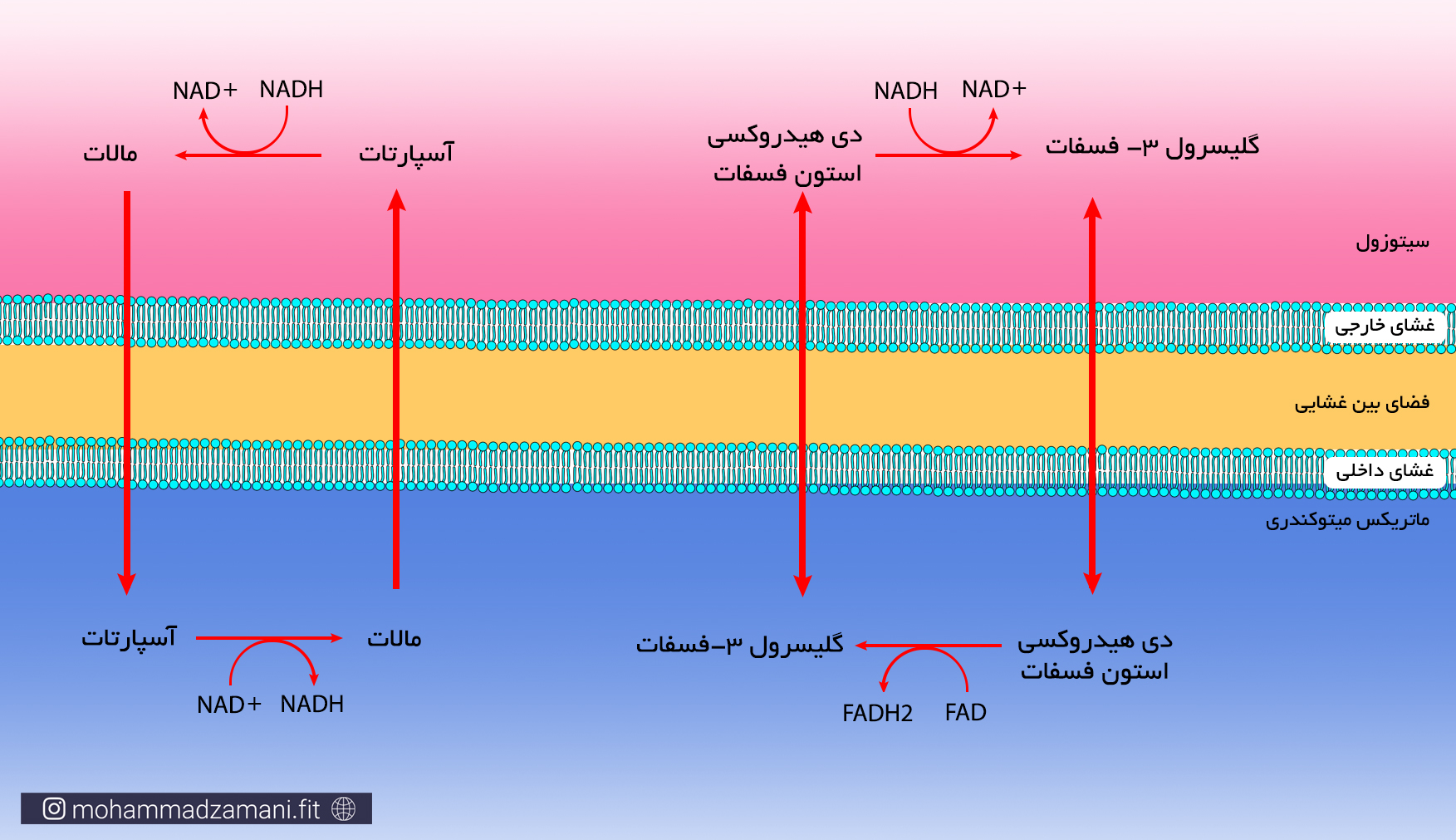
شاتل گلیسرول 3-فسفات و مالات-آسپارتات
سومین منبع انرژی، یعنی پروتئین چگونه می سوزد؟
همانطور که پیش تر نیز اشاره شد، پروتئین از واحد های ساختاری کوچک تر به نام اسیدهای آمینه ساخته شده است که برخی از آن ها قابلیت این را دارند که به عنوان سوخت مورد استفاده قرار بگیرند. در افرادی که تغذیه ی خوبی دارند، حدود 2 تا 5% کل انرژی مورد بدن در حالت استراحتی، از سوختن پروتئین تأمین می شود.
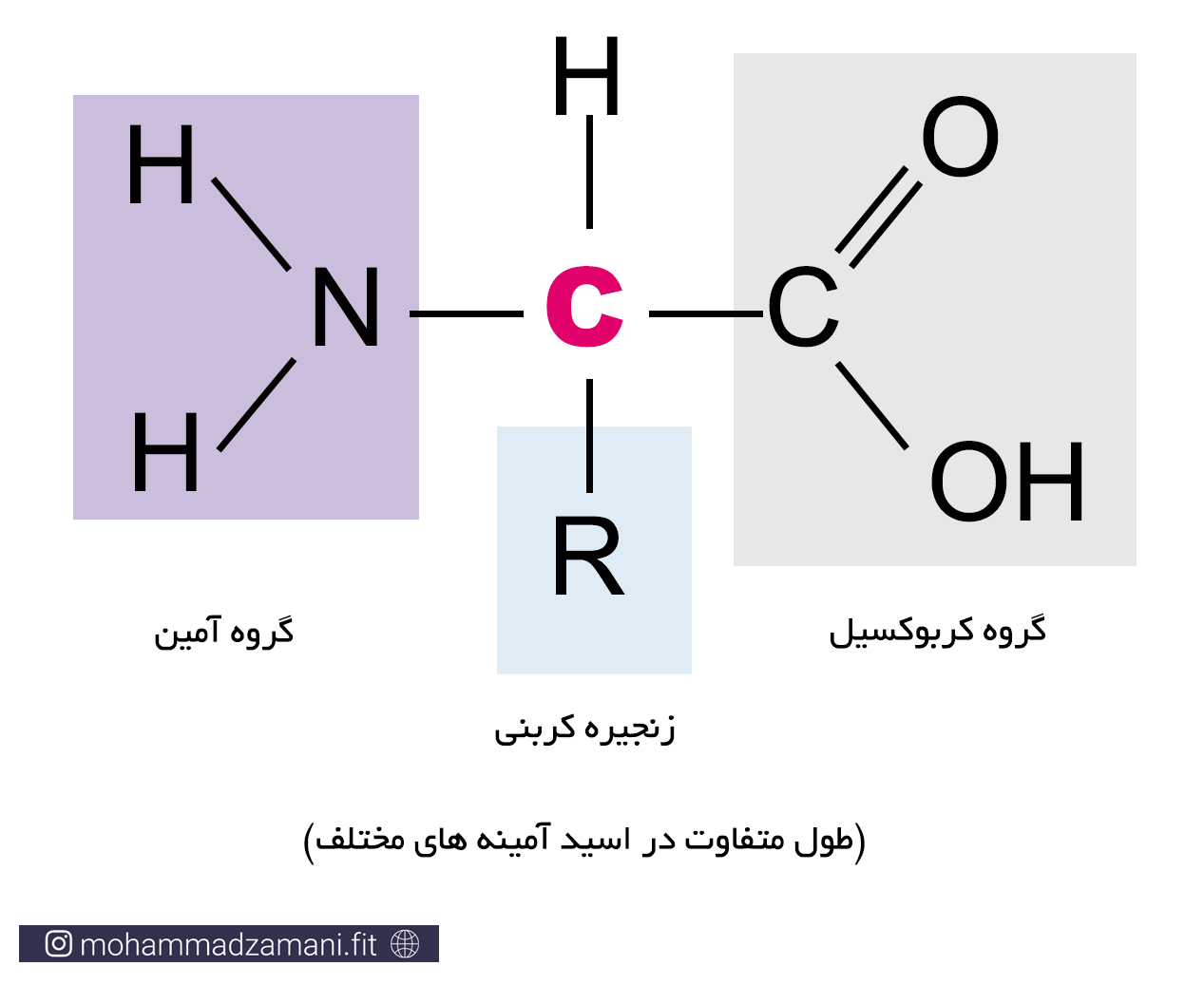
ساختار اسیدآمینه، شامل یک گروه آمینی (NH2)، یک گروه کربوکسیل (COOH) و یک بدنه کربنی است که در شکل زیر می توانید مشاهده کنید.
قبل از ورود به مسیر های سوختی، گروه آمینه باید از اسیدآمینه جدا شود که به این فرایند، دِآمیناسیون می گویند. کبد اصلی ترین جایگاه فرایند دِآمیناسیون است. با این حال برخی از اسیدهای آمینه قابلیت دِآمیناسیون در عضلات را نیز دارند. این اسیدهای آمینه، پس از از دست دادن گروه آمینی خود، به آلفا-کتواسید (مانند پیرووات، الفا-کتوگلوتارات، اگزالواستات، ...) یا گلوتامات تبدیل می شود. برای ورود به مسیر های انرژی، این اسیدهای آمینه، پس از دِآمینه شدن، به یکی از میانجی های چرخه کربس تبدیل شده و به این ترتیب به انرژی تبدیل می شود. در شکل زیر، این فرآیند نشان داده شده است.
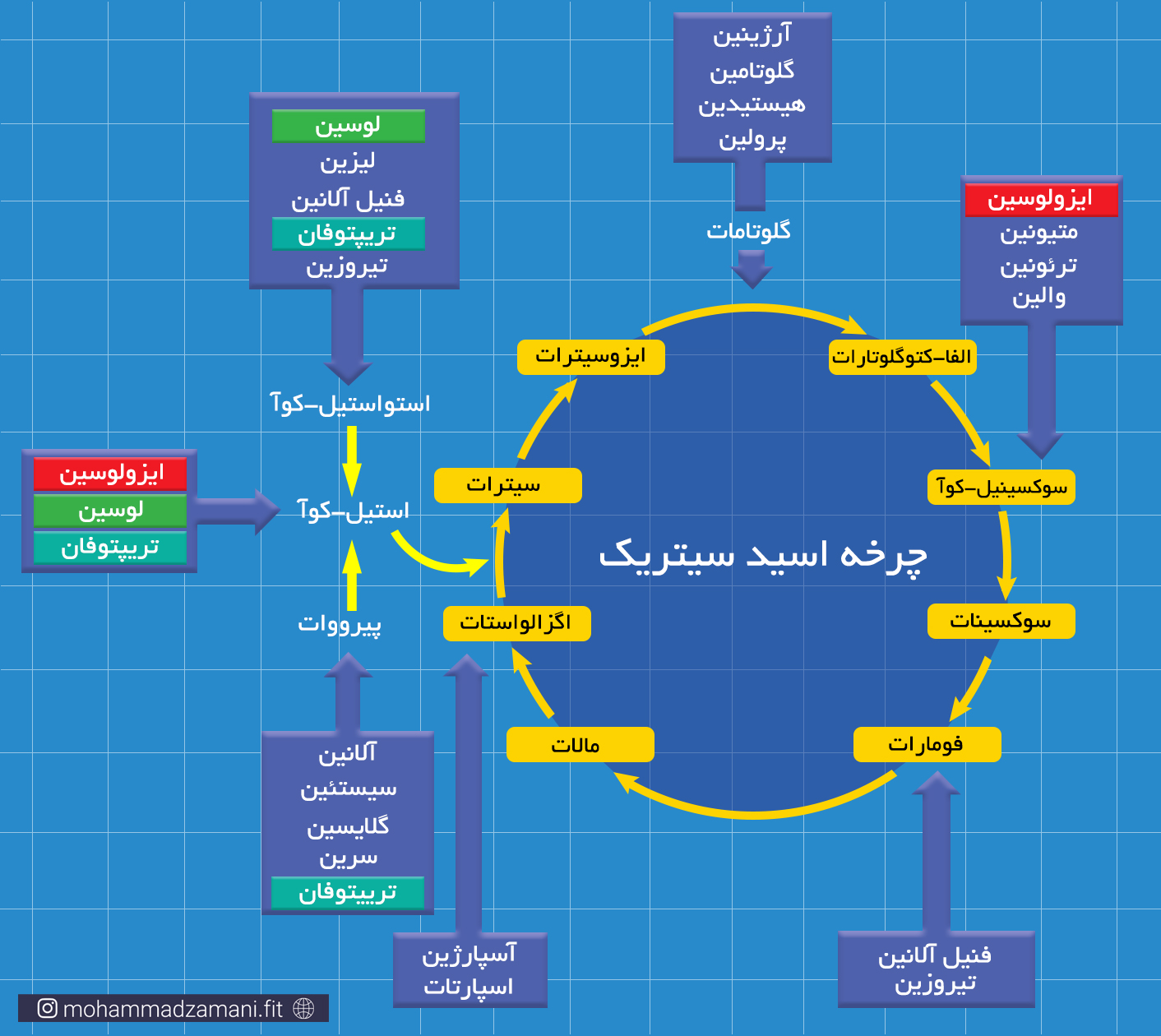
مسیر ورود اسیدهای آمینه مختلف به چرخه کربس
بنابراین، بسته به نوع اسیدآمینه، تعداد ATP تولید شده از سوختن آن می تواند کمی متفاوت باشد. اما همانطور که مشاهده می کنید، به دلیل این که از میانه راه وارد مسیر تولید انرژی می شود و نمی تواند به شکل بی هوازی بسوزد، نسبت به دو سوخت دیگر، یعنی گلوکز و چربی، انرژی کمتری می تواند تولید کند.
فصل چهارم: بازده انرژی حاصل از سوخت درشت مغذی ها
چه می آموزیم؟
تا اینجا با فرایند سوخت هر سه درشت مغذی، یعنی کربوهیدرات، چربی و پروتئین آشنا شدیم. حال بیایید ببینیم کدامیک از این سوخت ها برای بدن به صرفه تر است و هریک چه مقدار انرژی تولید می کند.
کدام سوخت انرژی بیشتری تولید می کند؟
کربوهیدرات و چربی، دو سوخت اصلی بدن هنگام استراحت و فعالیت هستند. با این حال، مقدار انرژی تولید شده از سوختن یک مولکول گلوکز، قابل مقایسه با چربی نیست. همانطور که از توضیحات ارائه شده در متابولیسم انرژی برمی آید، سوختن یک مولکول پالمیتیک اسید، می تواند چندین برابر یک مولکول گلوکز، انرژی تولید کند. چربی در بدن، به شکل مولکولهای تری گلیسیرید وجود دارد. تری گلیسیرید، از یک مولکول گلیسرول و سه مولکول اسیدچرب تشکیل شده است.
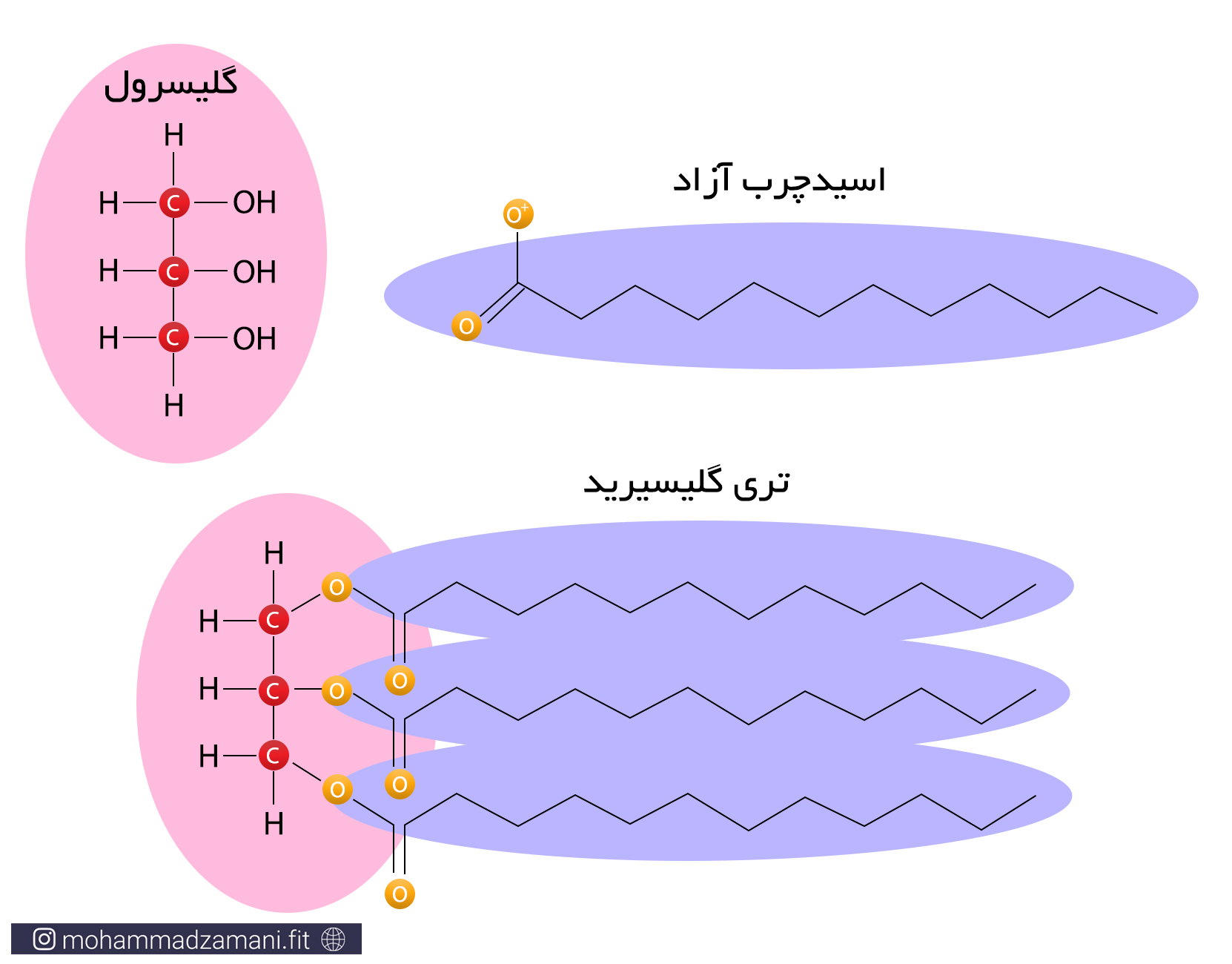
یک مولکول چربی
زمانی که مولکول تری گلیسیرید وارد مسیر سوخت می شود، هر دو قسمت اسیدچرب و گلیسرول آن می سوزد. گلیسرول یک مولکول قندی سه کربنه است که می تواند به 3-فسفوگلیسرآلدهید تبدیل شده و از میانه راه، وارد فرآیند گلیکولیز شود. برای مثال از سوختن یک مولکول تری گلیسیرید حاوی سه مولکول لینولئیک اسید و یک گلیسرول، می تواند 460 مولکول ATP تولید شود.
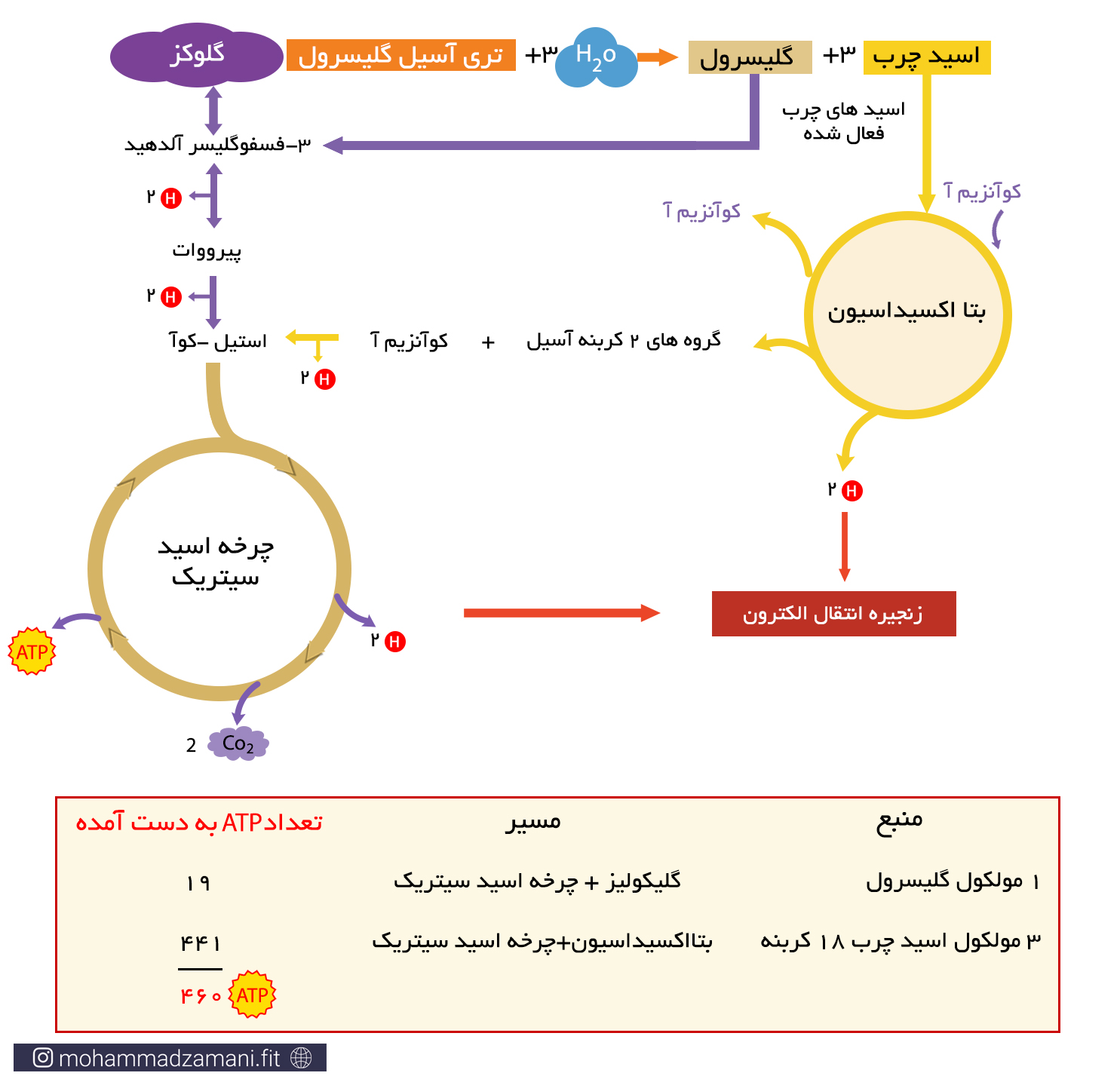
تعداد ATP حاصل از سوختن یک مولکول چربی 18 کربنه
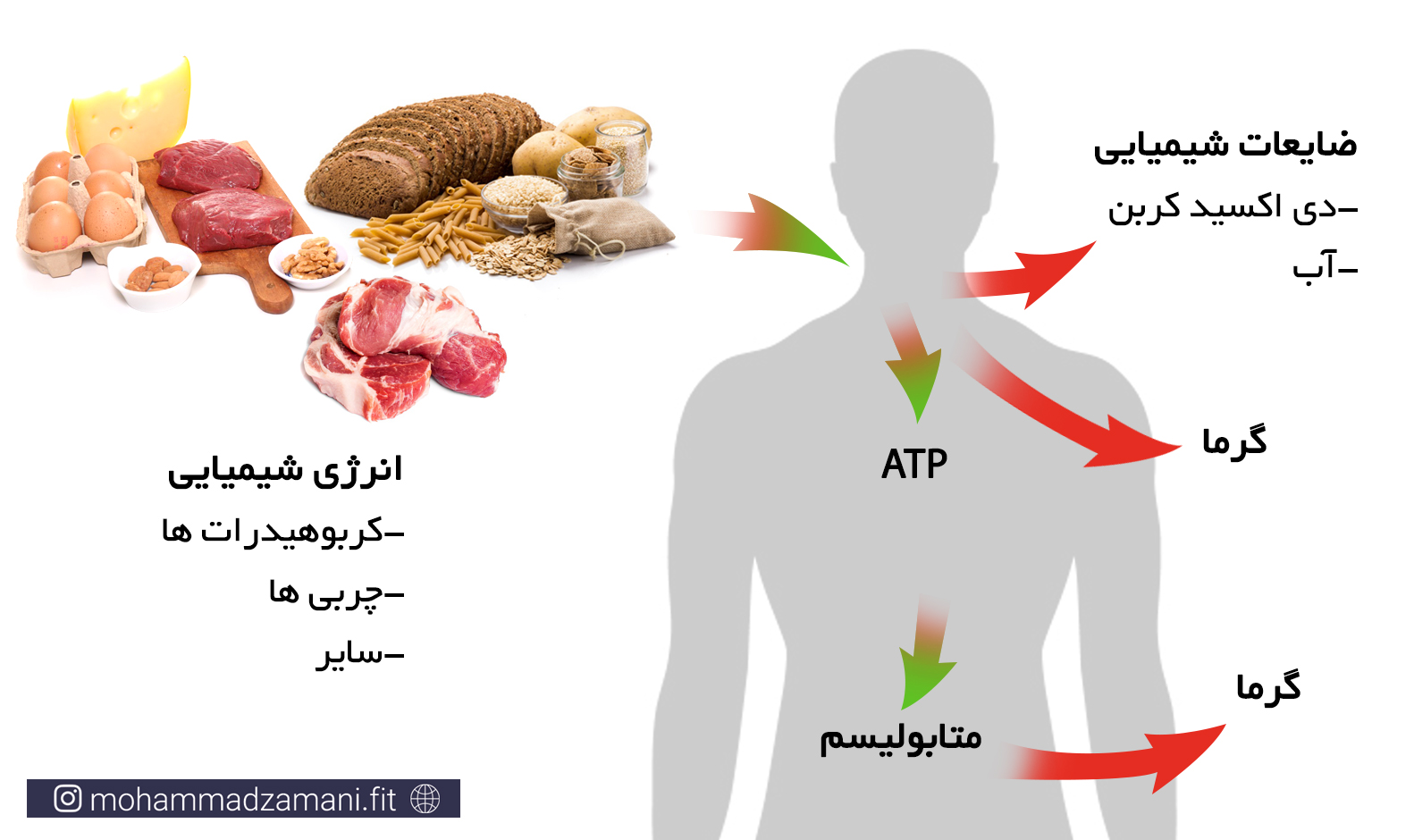
غذایی که ما می خوریم، چگونه به انرژی تبدیل می شود؟
بیایید ببینیم هر ماده غذایی که ما مصرف می کنیم، چه مسیری را طی می کند تا تبدیل به انرژی شود. در شکل زیر این فرایند به سه مرحله تقسیم شده است.
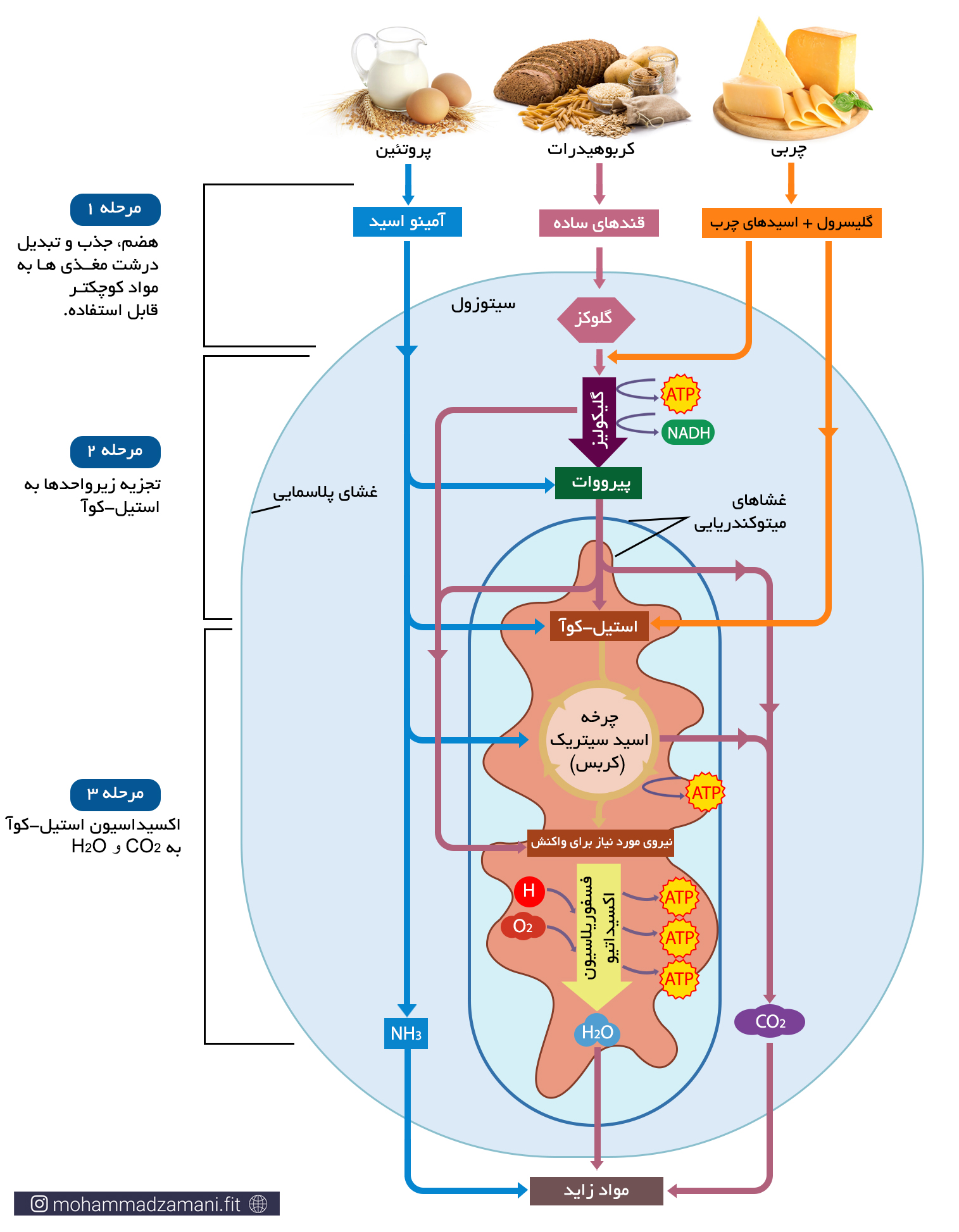
به طور معمول، فرایند تبدیل غذای مصرفی به انرژی، تنها به این ترتیب در بدن اتفاق نمی افتد. زمانی که ما غذا می خوریم، مرحله 1 در هر صورت انجام می شود. اما ممکن است گلوکز، اسیدآمینه و اسید چرب حاصل از آن، وارد مسیرهای تولید انرژی نشود. بلکه یا برای فرآیندهای سنتز مولکول های مختلف، مانند هورمون ها، پیامرسان ها، ... و رشد مورد استفاده قرار بگیرد، یا در بدن ذخیره شود. همانطور که پیشتر گفته شد، اصلی ترین ذخیره بدن، چربی است و در رتبه بعدی گلیکوژن و در آخر اسیدآمینه قرار دارد. چنانچه ذخایر گلیکوژنی کبد و عضلات به میزان کافی وجود داشته باشد، انرژی دریافتی اضافی، به چربی تبدیل شده و در بدن ذخیره می شود.
بیشتر بدانیم
سنتز چربی
سنتز تری گلیسیرید، به عنوان مولکول سازنده چربی در بدن، یک فرایند کنترل شده است که به طور عمده در بافت چربی اتفاق می افتد؛ اما کبد، عضلات، قلب و پانکراس نیز توانایی سنتز آن را دارند. فرایند سنتز TAG (تری-آسیل گلیسرول) از اسیدهای چرب –که به آن لیپوژنز می گویند- به طور کامل در سیتوزول سلول اتفاق می افتد و شامل فعال شدن FFA (اسیدهای چرب آزاد) به صورت تبدیل به آسیل چرب-کوآ و سپس تولید MAG (مونو-آسیل گلیسرول) و DAG (دی-آسیل گلیسرول)، به وسیله واکنش با G3P (گلیسرول 3-فسفات) است. سپس DAG با کمک آنزیم DGAT (دی-آسیل گلیسرول آسیل ترانسفراز)، به TAG (تری-آسیل گلیسرول) یا همان تری گلیسیرید تبدیل می شود.
اما FFA مورد نیاز برای سنتز TG (تریگلیسیرید) از کجا می آید؟
همانطور که قبلاً نیز گفتیم و در شکل بالا نیز مشخص است، هر چه ما می خوریم، توسط سیستم گوارش ما به یکی از سه مولکول اسیدچرب، اسید آمینه و گلوکز تبدیل می شود. اسیدچرب بدست آمده از این مسیر، عمدتاً به شکل FFA و یا در ترکیب با پروتئین های حامل، وارد جریان خون شده و توسط بافت ها برداشت می شود. از کل FFAها، آنچه مورد نیاز بافت هاست استفاده شده و ما بقی توسط بافت چربی برداشته شده و برای تولید TG مورد استفاده قرار می گیرید.
اما گفتیم، همه مواد غذایی که ما به شکل مازاد دریافت می کنیم، در نهایت به چربی تبدیل می شود. اما چگونه؟
مسیر سوخت گلوکز و اسید آمینه را بخاطر بیاورید. هر دو این مواد در مسیر خود درون میتوکندری، وارد چرخه کربس می شوند. زمانی که سوخت اولیه بیش از مقدار مورد نیاز وارد سلول می شود، میانجی های چرخه کربس بیش از اندازه تولید شده و تجمع می یابند که مهم ترین آن ها سیترات است. سیترات از معدود مولکول هایی است که پس تولید در این چرخه، می تواند از غشای میتوکندری بگذرد و وارد سیتوزول شود. سیترات پس از ورود به سیتوزول، به اگزالواستات و استیل-کوآ تجزیه می شود. اگزالو استات ابتدا به مالات و سپس به پیرووات تبدیل می شود. پیرووات مجدداً وارد میتوکندری شده و وارد چرخه کربس می شود. اما استیل-کوآ، توسط آنزیم استیل-کوآ کربوکسیلاز، به مالونیل کوآ تبدیل شده و سپس توسط مجموعه ای از آنزیم ها موسوم به اسیدچرب سنتاز (Fatty acid synthase) (FASN) و طی چند واکنش پیاپی، به اسید چرب تبدیل می شود. اسیدهای چرب تولید شده، سپس فعال شده و وارد فرآیند تولید TG می شوند.
شاید بپرسید که پیرووات در فرآیند گلیکولیز، می توانست مستقیماً به استیل-کوآ تبدیل شود. پس چرا اکنون نیاز دارد وارد چرخه شود، سیترات تولید کند و سپس سیترات استیل-کوآ را بازسازی کند؟
به یاد داشته باشید که فرآیند تبدیل پیرووات به استیل-کوآ داخل میتوکندری اتفاق می افتد، در حالی که سنتز چربی درون سیتوزول انجام می شود. استیل-کوآ تولید شده داخل میتوکندری، توانایی عبور از غشای میتوکندری و ورود به سیتوزول را ندارد. به همین دلیل ابتدا وارد چرخه شده و با ترکیب با اگزالواستات، سیترات را می سازد و پس از عبور از غشای میتوکندری، از سیترات جدا می شود و وارد فرآیند سنتز چربی می شود.
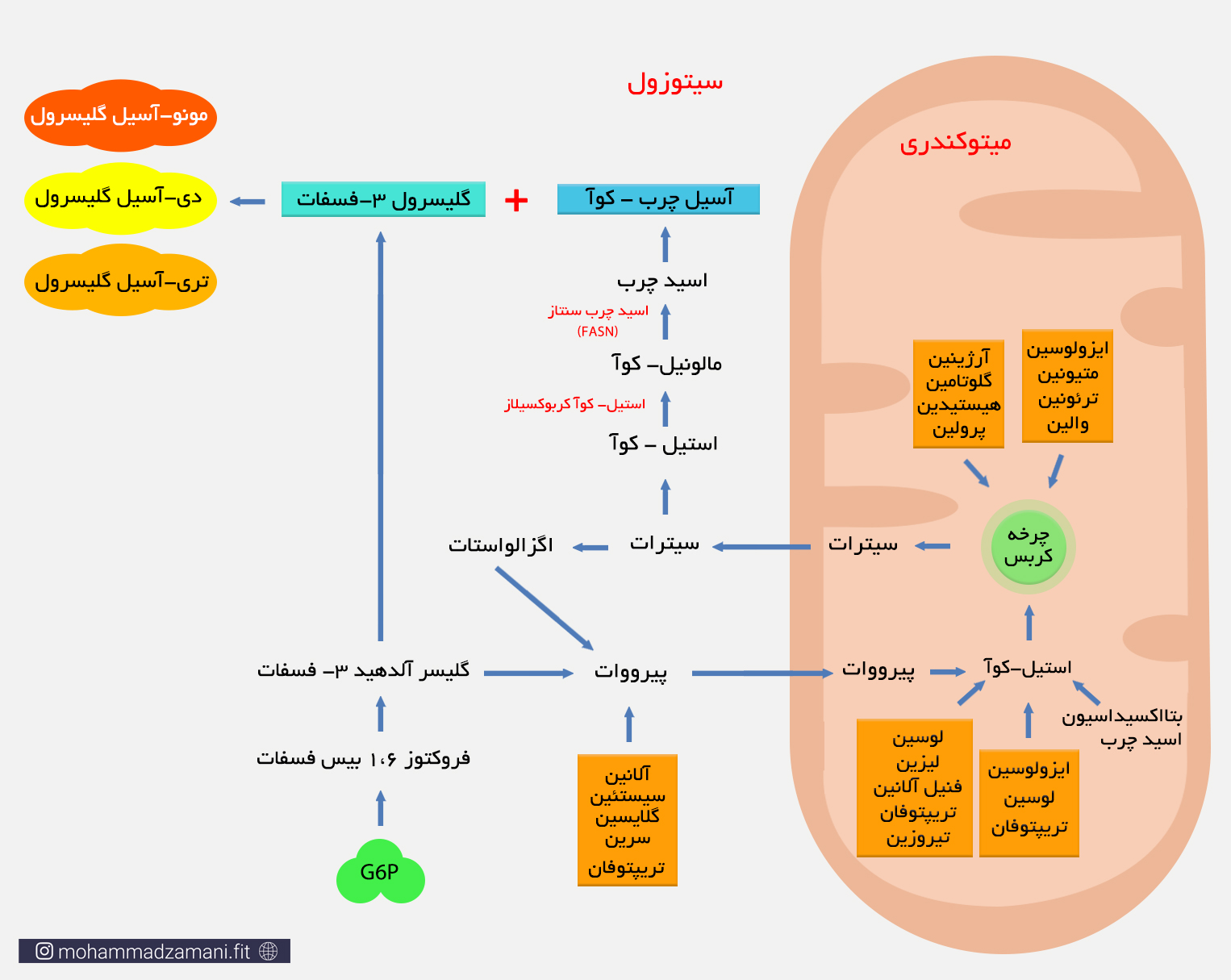
روند سنتز تری گلیسیرید از درشت مغذی های مصرف شده که در اثر فرآیند هضم، به اسید چرب، اسید آمینه و گلوکز تبدیل می شود. دقت کنید که بیشترین تولید تری گلیسیرید از چربی خوراکی در بافت چربی و بیشترین تولید آن از کربوهیدرات و پروتئین، در سایر بافت ها و عمدتاً در کبد انفاق می افتد. البته از میزان تولید چربی از کربوهیدرات، قابل مقایسه با تولید آن از پروتئین نیست و آنچه بیشتر در بدن اتفاق می افتد، تولید چربی از دریافت کربوهیدرات مازاد است که به صورت چربی درون بافتی در کبد تجمع کرده و منجر به بیماری کبد چرب غیر الکلی (NAFL) می شود.
روند تولید تری گلیسیرید از اسید چرب حاصل از مواد غذایی، عمدتاً در بافت چربی اتفاق می افتد، در حالی که تولید تری گلیسیرید از اسیدهای چرب بدست آمده از عمدتاً گلوکز و اندکی پروتئین، بیشتر در کبد اتفاق می افتد. زمانی که ما غذا می خوریم، گلوکز حاصل از تجزیه کربوهیدرات، توسط کبد برداشت شده و بخشی از آن برای بازسازی ذخایر گلیکوژن کبدی مورد استفاده قرار می گیرد. مابقی، طی فرایندی که در بالا توضیح داده شد، به اسیدچرب و عمدتاً پالمیتات تبدیل می شود. کبد از این چربی ها برای مصارف گوناگون و عمدتاً سنتز لیپوپروتئین ها و تری گلیسیری استفاده می کند. تری گلیسیرید بدست آمده از این فرآیند درون کبد ذخیره شده و لیپوپروتئین ها، از جمله HDL، LDL و VLDL درون خون رها می شوند. نشان داده شده است که 10 تا 35 درصد از ذخایر VLDL و TG بدن، از این طریق ساخته می شود که در افراد چاق، لاغر و مبتلا به مقاومت انسولینی مقدار آن متفاوت است (15و16).
انرژی مورد نیاز در حین فعالیت ورزشی بیشتر از کدام سوخت تأمین می شود؟
زمانی که ما شروع به فعالیت ورزشی می کنیم، چهار منبع اصلی، وظیفه تأمین سوخت مورد نیاز عضلات اسکلتی را دارند. ذخایر گلیکوژن عضلانی، ذخایر تری گلیسیرید عضلانی، اسیدهای چرب آزاد خون (FFA) و قند خون. همواره سطح مشخصی از FFA در جریان خون وجود دارد. با مصرف آن ها، ذخایر تری گلیسیرید در بافت چربی تجزیه شده و وارد جریان خون می شود. آنزیم تجزیه کننده چربی (لیپاز) موجود در دیواره عروق، می تواند این تری گلیسیریدها را تجزیه کرده و ذخایر خونی FFA را بازسازی کند. در مورد قند خون نیز، روند مشابهی اتفاق می افتد. با این تفاوت که تنها منبع تأمین کننده قند خون در بدن، کبد است. زمانی که قند خون مصرف می شود، ذخایر گلیکوژنی کبد تجزیه شده و قند تولید شده را به درون جریان خون می ریزد. از آنجایی که سهم اسیدآمینه در تآمین انرژی مورد نیاز در حین فعالیت ورزشی بسیار ناچیز است، از آن چشم پوشی می کنیم.
بسته به شدت فعالیت ورزشی، سهم هرکدام منابع تأمین انرژی ذکر شده در عضلات، می تواند تغییر کند. در نمودار زیر، سهم هرکدام از سوخت های انرژی، در دوچرخه سواران حرفه ای، طی یک وهله فعالیت با شدت فزاینده نشان داده است (13).
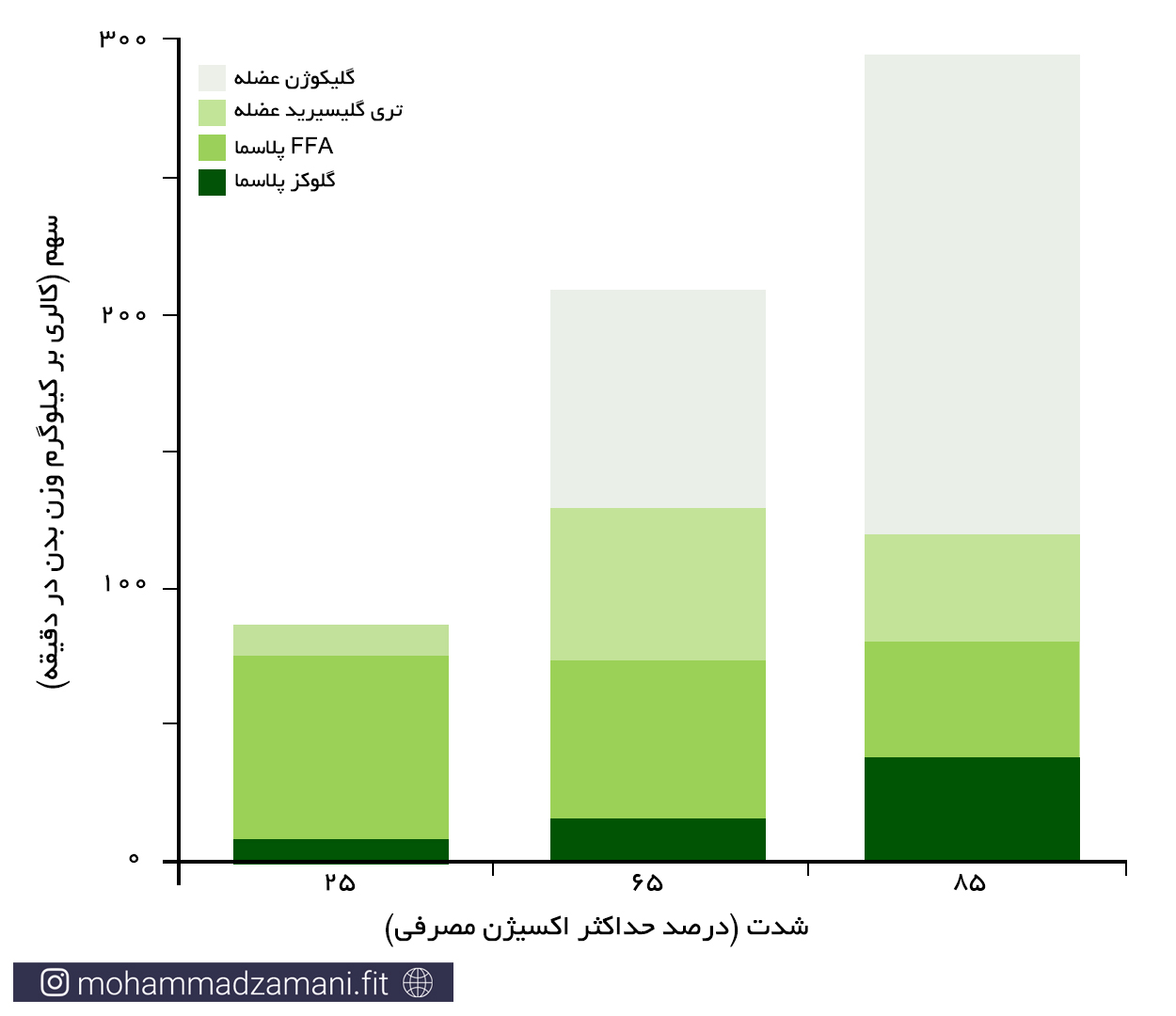
سهم نسبی منابع سوختی چربی و کربوهیدرات در حین فعالیت ورزشی
منابع
- https://journals.humankinetics.com/view/journals/ijsnem/11/1/article-p87.xml
- https://books.google.com/books?id=Go_ODwAAQBAJ&dq=lipid+metabolism+in+cell&hl=en&sa=X&ved=2ahUKEwiXr4WbgpfyAhUR6RoKHcpVDdgQ6AEwAXoECAcQAg
- https://www.amazon.com/s?k=9780721644523&i=stripbooks&linkCode=qs
- https://www.elsevier.com/books/carbohydrate-metabolism/dickens/978-1-4832-2754-2
- https://www.amazon.com/Exercise-Physiology-Nutrition-Energy-Performance/dp/1451191553
- https://pubmed.ncbi.nlm.nih.gov/18840763/
- https://strengthmatters.com/what-is-the-anaerobic-alactic-energy-system-a-beginners-guide-2019-edition/
- https://www.amazon.com/Jeremy-Berg-Biochemistry-7th/dp/B00HTKE5YG
(figure 15.7)
- https://www.amazon.de/Periodization-Training-Sports-Tudor-Bompa/dp/1450469434
- https://www.amazon.de/Exercise-Physiology-Nutrition-Performance-International/dp/1451193831
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1267003/
- https://www.nobelprize.org/prizes/medicine/1953/krebs/facts/
- https://www.nature.com/articles/s42255-020-0251-4
- https://en.wikipedia.org/wiki/Glycolysis#History
- https://pubmed.ncbi.nlm.nih.gov/15640457/#:~:text=Results%3A%20The%20temporal%20pattern%20of,was%20similar%20in%20all%20subjects.&text=Lipogenesis%20peaked%204.2%20h%20after,from%2010.3%25%20to%2037.5%25.
- https://pubmed.ncbi.nlm.nih.gov/26580649/


